Wkrótce zbliżamy się do 100 lat od pierwszego rozpoznania choroby Newcastle (ND), która nadal stanowi wyzwanie dla przemysłu drobiarskiego na całym świecie, powodując katastrofalne straty w niektórych krajach. W przeciągu tego okresu dokonano ulepszeń metod lepszej kontroli choroby, a postępy w opracowywaniu szczepionek umożliwiły znaczący wpływ na zwalczanie tej choroby.
Choroba Newcastle (ang. ND, Newcastle disease) to jedna z najważniejszych jednostek chorobowych u drobiu oraz innych gatunków ptaków, stanowiących zagrożenie w przemysłowej produkcji drobiu na całym świecie.
Chorobę wywołują określone szczepy paramyksowirusa ptasiego serotypu 1, należącego do rodziny Paramyxoviridae. Ten posiadający otoczkę wirus cechuje się tropizmem do nabłonka dróg oddechowych oraz zmienną chorobotwórczością: od formy łagodnej po przebiegającą z bardzo wysoką śmiertelnością [1]. Choroba szerzy się głównie poprzez bezpośredni kontakt z zakażonymi ptakami, drogą kropelkową i przez zanieczyszczoną ściółkę. Innymi źródłami zakażenia są zanieczyszczony sprzęt, padłe ptaki, woda, pasza i pracownicy fermy. Ludzie i pojazdy mogą z łatwością przenosić wirus pomiędzy kurnikami oraz pomiędzy fermami. Wirus choroby Newcastle nie jest chorobotwórczy dla ludzi, aczkolwiek kontakt z wirusem zjadliwym terenowym lub nawet serotypem szczepionkowym może wywoływać podrażnienie górnych dróg oddechowych oraz być przyczyną łagodnego zapalenia spojówek [2].
Wśród objawów klinicznych u zakażonych ptaków dominują zwykle objawy ze strony układu pokarmowego i nerwowego (np. skręt szyi), jednak relatywnie często obserwujemy także zmiany patologiczne w obrębie układu oddechowego.
W przebiegu łagodnej postaci choroby zmiany ze strony układu oddechowego dość często bywają prawie niedostrzegalne, lecz w formie ostrej potrafią być silnie wyrażone poprzez osowiałość, ostre zaburzenia oddechowe, spadek nieśności, długo utrzymujące objawy neurologiczne czy uporczywą biegunkę. Ostra forma choroby zawsze odznacza się zwiększeniem upadków, a w ciężkich postaciach choroby śmiertelność jest bardzo wysoka osiągając nawet 70% zakażonego stada [3].
Nasilenie objawów chorobowych jest uwarunkowane wieloma czynnikami, wśród których za najważniejsze uznaje się sam szczep wirusa, gatunek zakażonych ptaków oraz ogólny status zdrowotny stada.
Izolaty wirusa choroby Newcastle (ang. NDV, Newcastle disease virus) są podzielone na pięć patotypów powiązanych z nasileniem wyrażenia objawów klinicznych pojawiających się u zakażonych ptaków kurcząt [3]:
- szczepy welogeniczne wiscerotropowe – wirusy o wysokiej zjadliwości, które powodują zakażenia skutkujące wysokimi upadkami przebiegającymi z ostrymi, krwotocznymi zmianami patologicznymi w układzie pokarmowym;
- szczepy welogeniczne neurotropowe – wirusy wysoce zjadliwe wywołujące objawy oddechowe i neurologiczne, skutkujące wysoką śmiertelnością w obrębie stada;
- szczepy mezogeniczne – wirusy o umiarkowanej zjadliwości i powodujące często ostre objawy oddechowe, ale zwykle niską śmiertelność (do 25%), umiarkowany spadek nieśności i niezbyt silnie wyrażone objawy neurologiczne u niektórych ptaków;
- szczepy lentogeniczne – wirusy o niskiej zjadliwości, zakażenie którymi skutkuje brakiem objawów klinicznych lub łagodną formą zakażenia układu oddechowego. Obserwuje się łagodne objawy ze strony układu oddechowego, niską śmiertelność i na ogół brak lub niewielki spadek nieśności.
- apatogenne szczepy enterotropowe – są to niezjadliwe wirusy, które przypuszczalnie namnażają się głównie w układzie pokarmowym, a zakażenie nimi nie powoduje choroby w postaci klinicznej.
Granice między powyższymi grupami nie są jednoznaczne i objawy powiązane z określonymi grupami wirusa pokrywają się tylko w pewnym zakresie. Próba rozdzielenia pomiędzy tymi grupami skutkowała wprowadzeniem parametru ICPI (Intracerebral Pathogenicity Index / Indeks zakaźności domózgowej), którego wysokość wyrażona jest w zakresie od 0 (brak objawów) do 2 (śmierć osobnika) [4,5]. I tak, za patotypy lentogeniczne i asymptomatyczne enterotropowe uznano szczepy wirusów o ICPI poniżej 0,6, zaś za szczepy mezogeniczne te o indeksie ICPI pomiędzy 0,7 a 1,6. Wszystkie szczepy wirusa ND z indeksem ICPI powyżej 1,6 uznano początkowo za welogeniczne [3]. Jednak według aktualnej rekomendacji OIE oraz przepisów wewnętrznych Unii Europejskiej wszystkie szczepy NDV o ICPI powyżej 0,7 uznaje się za szczepy welogeniczne [3,6].
Stosowane w ostatnich latach techniki biologii molekularnej umożliwiają coraz głębsze poznawanie chorobotwórczości i antygenowości NDV. Udoskonalone techniki sekwencjonowania nukleotydów i dostępność danych posekwencyjnych dotyczących coraz większej liczby wirusów ND dostarczają nam coraz bardziej miarodajne wyniki analizy filogenetycznej. Na ich podstawie potwierdzono, że różne genotypy APMV-1 krążą w różnych częściach świata i chociaż wszystkie NDV należą do grupy APMV-1, to pomiędzy nimi istnieje relatywnie duża różnorodność antygenowa [7]. Aktualnie na świecie współistnieją dwa różne systemy klasyfikacji NDV, ale nie ma też zgody co do tego, który z nich jest bardziej odpowiedni [8,4]. Pierwszy system dzieli wirusy ND na sześć głównych grup genetycznych i dodatkowe trzy podgrupy [4]. Drugi system klasyfikuje NDV na dwa główne działy reprezentowane przez klasę I i II, przy czym klasa I jest dalej podzielona na dziewięć genotypów, a klasę II na dziesięć, porównując sekwencje izolowane w różnym czasie [9]. Reasumując, to jednak oba systemy klasyfikacja opiera się zatem na podobnych informacjach genomowych, dlatego rozbieżności między dwoma systemami klasyfikacji są umowne [10].
Objawy kliniczne i zmiany patologiczne
Rzekomy Pomór Drobiu jest chorobą bardzo zaraźliwą dla wielu gatunków ptaków domowych, egzotycznych oraz dziko żyjących. Dzikie ptaki, zwłaszcza sezonowo migrujące, są ważnym wektorem w transmisji wirusów terenowych.
Cechuje się – zależnie od tropizmu wirusa – bardzo zróżnicowanym stopniem zachorowalności, śmiertelności oraz zakresem objawów klinicznych i zmian patologicznych, które morfologicznie mają wyraźnie charakter wiscero- lub neurotropowy [11,3].
Zakażenie szerzy się głównie drogą pokarmową i kropelkową, zaś do infekcji drogą aerogenną lub przez kontakt bezpośredni dochodzi rzadziej. Uznaje się że brak jest możliwości transmisji pionowej, ponieważ wirus znajdujący się w inkubowanych jajach powoduje śmierć zarodka, po czym sam ginie.
W obrazie klinicznym neurotropowej postaci choroby dominuje niezborność ruchowa, opistotonus, skręty szyi, niedowład i porażenie kończyn dolnych. Towarzyszą temu często objawy oddechowe i wysoka śmiertelność, sięgająca nawet 70-100% (Fot. 1 i 2)

Fot.1 |

Fot.2 |
Reakcję na kontakt z wirusem NDV bardzo często można zauważyć w końcowych fragmentach przewodu pokarmowego ptaka. Najczęściej stwierdza się wylewy krwawe i powiększenie migdałków jelita ślepego (Fot. 3) oraz regularne, punkcikowate wybroczyny w jelicie prostym (Fot. 4).
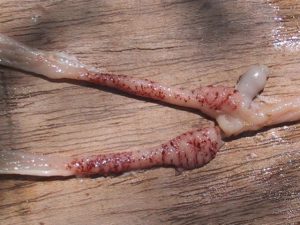
Fot.3 |
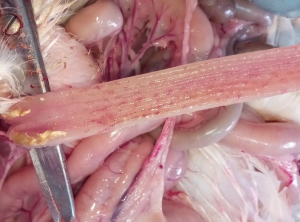
Fot.4 |
Odchody chorych ptaków zawierające wirus zanieczyszczają paszę, wodę i otoczenie, stanowiąc źródło zakażenia.
W przebiegu wiscerotropowej postaci choroby krwotoczno-dyfteroidalne zmiany w przewodzie pokarmowym, na odcinku od dzioba do steku. Obserwujemy charakterystyczne wybroczyny w nabłonku żołądka mięśniowego (Fot. 5). Błona śluzowa jest obrzękła, pokryta gęstym śluzem i nastrzykana pojedynczymi albo mnogimi wybroczynami, które są niekiedy zlokalizowane w skupiskach na obrzeżach żołądka mięśniowego lub przełyku (Fot. 6).
W przebiegu wiscerotropowej postaci choroby krwotoczno-dyfteroidalne zmiany w przewodzie pokarmowym, na odcinku od dzioba do steku. Obserwujemy charakterystyczne wybroczyny w nabłonku żołądka mięśniowego (Fot. 5). Błona śluzowa jest obrzękła, pokryta gęstym śluzem i nastrzykana pojedynczymi albo mnogimi wybroczynami, które są niekiedy zlokalizowane w skupiskach na obrzeżach żołądka mięśniowego lub przełyku (Fot. 6).
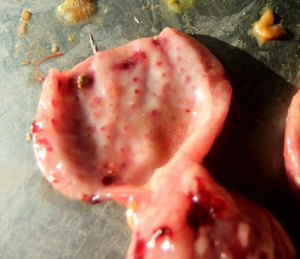
Fot.5 |
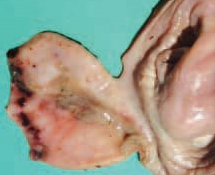
Fot.6 |
Białe jaja (Fot. 7 i 8) albo każda zmiana barwy na znacznie jaśniejszą, będąca odchyleniem od prawidłowego koloru, może być jednym z pierwszych objawów zakażenia wirusem Newcastle lento- lub mezogenicznym [12].
Obraz tej choroby może być bardzo zróżnicowany, od praktycznie niezauważalnego po umiarkowany spadek nieśności, czemu na ogół towarzyszą łagodne objawy ze strony układu oddechowego i niska śmiertelność.

Fot.7 |

Fot.8 |
Jednak Choroba Newcastle to przede wszystkim schorzenie układu oddechowego, występujące u kurcząt w każdym wieku (Fot. 9 i 10). Wirus wnika przez błony śluzowe górnych dróg oddechowych i intensywnie replikując niszczy ich nabłonek, a następnie infekuje inne organy wewnętrze. Zatem ochrona całego organizmu, nawet w postaci swoistych przeciwciał krążących sama w sobie nie jest wystarczającym zabezpieczeniem układu oddechowego. By zapobiec miejscowym uszkodzeniom tkanek konieczna jest silna odporność miejscowa, która zapewni pełną ochronę układu oddechowego przed zakażeniem NDV [13,11].

Fot.9 |
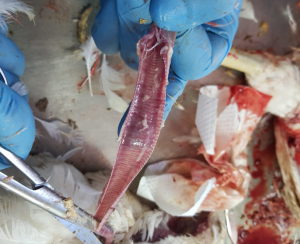
Fot.10 |
Szczepy wirusa ND mogą mieć różne preferencje względem narządów docelowych (tropizm). Są szczepy cechujące się wysokim powinowactwem (tropizmem) do układu oddechowego (szczepy pneumotropowe), a inne mają wysoki tropizm do przewodu pokarmowego (szczepy enterotropowe). Szczepy wirusa ND mające wysoki tropizm oddechowy (La Sota, VH, Clone 30, Hitchner B1) są pierwszym wyborem w koncepcji szczepionek przeciwko ND, bowiem stymulują dobrą odporność miejscową w układzie oddechowym, tworząc pierwszą linię obrony przed zakażeniem wirusem ND. Szczepy jelitowe dla odróżnienia omijają układ oddechowy i namnażają się w przewodzie pokarmowym, więc tam inicjują miejscową odpowiedz immunologiczną [13].
Leczenie choroby
Nie istnieje leczenie choroby Newcastle. W większości krajów wprowadzono programy eliminacji tej choroby realizowane poprzez izolację ognisk zakażenia, obowiązkowy ubój stad zakażonych i mających z nimi kontakt stad podejrzanych oraz zakaz pozyskiwania produktów drobiarskich na terenach zapowietrzonych [3,6]. Ogniska wystąpienia choroby Newcastle w przemysłowych stadach drobiu należy zgłaszać do Światowej Organizacji Zdrowia Zwierząt (OIE), a ich pojawianie wpływa na międzynarodową wymianę handlową w sektorze drobiarskim. Uzyskanie kontroli choroby Newcastle w skali globalnej byłoby możliwe tylko wtedy, gdyby wszystkie kraje zgłaszały międzynarodowym instytucjom wszystkie wybuchy choroby pojawiające w obrębie granic danego państwa. Jednak często w krajach rozwijających się trudności przedstawia sama diagnostyka Choroby Newcastle, a strach przed administracyjnymi sankcjami powoduje, że lokalne endemie są eliminowane po cichu, bez zgłaszania choroby właściwym służbom weterynaryjnym.
Zapobieganie chorobie Newcastle
Środki dezynfekujące łatwo niszczą wirus, ale w ściółce może on zachować żywotność nawet przez 2 miesiące, a w ciałach padłych ptaków – nawet przez 12 miesięcy. Zatem podstawowa prewencja opiera się na dobrych procedurach bioasekuracji oraz szerokim stosowaniu szczepień profilaktycznych, a w wielu krajach szczepienia przeciwko chorobie Newcastle stały się obowiązkowe w przemysłowej produkcji drobiu [2,3].
Obecnie stosuje się różne strategie zapobiegania chorobie Newcastle [14]. Niektóre kraje zdecydowały się przyjąć zasady eliminacji choroby polegające na obowiązkowym uboju zakażonych ptaków. Inne kraje dopuszczają wyłącznie podawanie określonych żywych szczepionek wyprodukowanych w oparciu o szczepy lentogeniczne, a niektóre szczepionki uznają za zbyt zjadliwe. Co więcej, w pewnych krajach cały czas obecne są wysoce zjadliwe szczepy wirusa, ale zjawisko nie przybiera jawnej formy choroby właśnie z powodu obowiązkowych szczepień [15,12].
Szczepy wirusa ND wykorzystywane w komercyjnych żywych szczepionkach zalicza się do trzech grup:
- apatogenne / asymptomatyczne – takie jak C2, VG/GA, V4;
- lentogeniczne – np. Hitcher-B1, La Sota, VH, F;
- mezogeniczne – przykładowo Roakin, Mukteswar i Komarov.
Wszystkie z tych szczepów zostały wyselekcjonowane w sklonowane w taki sposób, by spełniały odpowiednie kryteria wyznaczone przez OIE dotyczące procesu ich produkcji i stosowania. Szczepionki te można podawać metodą indywidualną (w kropli do oka), albo poprzez aplikację masową (w formie aerozolowej lub z wodą do picia) [3].
Szczepienia przeciwko chorobie Newcastle
Odporność przeciwko chorobie Newcastle bazuje przede wszystkim na krążących w ustroju swoistych przeciwciałach (odporność humoralna, ogólna) oraz przeciwciałach wydzielniczych tworzących odporność błon śluzowych (odporność miejscowa). Wirus choroby Newcastle o niskiej zjadliwości (lentogeniczny) indukuje podobną odpowiedź ze strony układu immunologicznego, lecz nie powoduje ciężkiego zachorowania. Kurczęta, które przeżyły zakażenie zjadliwym wirusem ND wykształcają długotrwałą odporność zabezpieczającą przez kolejną infekcją wirusem ND [16].
Koncepcja szczepień przeciwko Rzekomemu Pomorowi Drobiu opiera się zasadniczo na stosowaniu [17]
- szczepionek żywych – które to są stworzone na bazie pełnego, „żywego” wirusa, który jest atenuowany (osłabiony), ale wciąż zdolny do zakażania komórek i wytwarzania silnej odporności bez wywoływania choroby. Wykorzystuje się szczepy wirusa o niskiej lub umiarkowanej zjadliwości, naśladujące przebieg naturalnego zakażenia i jednocześnie indukujące powstanie obu rodzajów odporności (miejscową i ogólną).
- szczepionek inaktywowanych – gdzie zdolność wirusa do zakazania komórek została wyeliminowana poprzez proces chemiczny lub fizyczny (promieniowanie, temperatura). Te szczepionki inicjują wyłącznie produkcję krążących w krwiobiegu przeciwciał, czyli odporność humoralną (ogólną).
- szczepionek wektorowych – które można pokrótce scharakteryzować jako produkt końcowy manipulacji genetycznej na kompetentnych immunologicznie genach pochodzących z dwóch różnych mikroorganizmów: wektora i donora. W efekcie dochodzi do indukcji odpowiedzi immunologicznej przeciwko zarówno patogenowi – wektorowi jak i patogenowi – dawcy. Te szczepionki także stymulują wyłącznie odporność humoralną.
Niezależnie od faktu jaki rodzaj szczepionki jest wprowadzony, celem nadrzędnym jest niedopuszczenie do zakażenia albo zmniejszenie liczby wrażliwych ptaków. Ochronę przed ND uzyskuje się poprzez zastosowanie żywych i/lub wektorowych/inaktywowanych szczepów szczepionkowych. Szczepienia chronią ptaki przed chorobą dzięki pojawieniu się przeciwciał lokalnych, humoralnych (ogólnoustrojowych), albo obu tych typów jednocześnie.
Podanie atenuowanego żywego wirusa miejscowo na błonę śluzowa inicjuje zarówno odporność miejscową jak i ogólnoustrojową, natomiast szczepienie drogą iniekcyjną szczepionką inaktywowaną lub wektorową prowadzi na ogół do powstania odporności układowej przy nieznacznej tylko ochronie miejscowej. Uważa się, że odporność przeciwwirusowa na błonach śluzowych jest uzależniona od produkowanych miejscowo przeciwciał (immunoglobuliny typu A – IgA) przedostających się przez nabłonek na powierzchnię błony śluzowej. Po zakażeniu IgA są produkowane głównie miejscowo i transportowane poprzez komórki nabłonka za pomocą komponentu wydzielniczego posiadającego aktywność neutralizującą wirusy bezpośrednio na błonie śluzowej, co ogranicza, ale nie zapobiega całkowicie namnażaniu się wirusa. Szczepy enterotropowe C2, VG/GA indukują produkcję miejscowych IgA głównie w przewodzie pokarmowym, zaś szczepy pneumotropowe B1, LaSota i VH indukują produkcję IgA swoistych dla NDV w górnych drogach oddechowych. Jednak głębsze badania szczepu VH dowodzą, że stymuluje on produkcję znacznych ilości IgA również w przewodzie pokarmowym.
Szczepy wirusa choroby Newcastle wykorzystywane w żywych oraz inaktywowanych szczepionkach
Szczepy pneumotropowe mezogeniczne
Od czasu wystąpienia pierwszych ognisk choroby Newcastle w Indonezji i Anglii w pierwszej połowie XX wieku przeprowadzono wiele badań naukowych dotyczących zapobiegania i zwalczania tej choroby poprzez szczepienia [Absalon]. Pierwsze badania polegały na podaniu w iniekcji inaktywowanego materiału wirusowego, ale problemy z produkcją i standaryzowaniem zniechęciły do jego stosowania na dużą skalę. Następnie atenuacja zjadliwych szczepów podejmowana w Indiach (szczep Mukteswar) [12], Palestynie (szczep Komarov) i USA (szczep Roakin) pozwoliła uzyskać wirusy o niskiej zjadliwości, które można było wykorzystać jako relatywnie bezpieczny antygen do szczepień masowych. Te szczepionki zapewniały bardzo dobrą ochronę przed zakażeniami terenowymi, ale pojawił się problem wynikający z samego charakteru wirusa [13]. Mianowicie, pomimo atenuacji jego potencjał zakaźny stwarzał ryzyko rewersji do formy zjadliwej, skutkującej pojawieniem się choroby i powodowania wysokiej śmiertelności w stadzie. Co więcej, szczepionki musiano stosować u ptaków powyżej czwartego tygodnia życia. Te czynniki sprawiły, że pojawiło się wyraźne zapotrzebowanie na bezpieczniejsze i tańsze szczepionki, które można byłoby stosować u młodszych ptaków.
Szczepy pneumotropowe lentogeniczne
W wielu krajach w pierwszej połowie XX. wieku prace nad stworzeniem żywej szczepionki przeciwko chorobie Newcastle było jednym z priorytetów. Wkrótce w USA, Hitchner opracował szczep wirusa B1, który dość szybko uzyskał licencję dopuszczającą go do użytku komercyjnego.
W 1950 r., ze względu na wciąż rosnące zapotrzebowanie na łagodne szczepionki przeciwko ND, w jednej z farm przemysłowych wyizolowano kolejny szczep, a jego wersję szczepionkową nazwano LaSota, od nazwiska hodowcy.
Jednakże wraz z globalnym rozwojem przemysłu drobiarskiego, odczyny poszczepionkowe stały się bardzo ważnym aspektem dla firm produkujących drób na skalę przemysłową. Jeden ze sposobów zmierzających do uzyskania szczepów szczepionkowych, które wywołałyby mniej odczynów poszczepiennych (ang. PVR, post-vaccination reactions), opierał się na selekcji subpopulacji wirusa, która namnażałaby się w jednorodną populację, co z kolei powodowałoby mniej odczynów poszczepiennych, przy jednoczesnym zachowaniu jej immunogenności. Przykładem takiego rozwiązania są „klonowane” szczepy wyselekcjonowane ze szczepu LaSota. Te klonowane szczepionki przeciwko chorobie Newcastle, takie jak VH, zostały wprowadzone na rynek w latach 90-tych i zostały dobrze przyjęte przez producentów drobiu i obsługujących ich lekarzy weterynarii [19,1,13].
Apatogenne, asymptomatyczne szczepy enterotropowe
Mimo że klonowane szczepionkowe szczepy lentogeniczne dawały słabsze odczyny poszczepienne niż ich wirusy macierzyste, szczepy te nadal powodowały pewne uszkodzenia układu oddechowego i zaczęto uważać je za niepożądane w przemysłowej produkcji drobiu. Ostatnio na rynek wprowadzono szczepy szczepionkowe wirusa ND przede wszystkim namnażające się w układzie pokarmowym a w nieznacznym tylko stopniu w układzie oddechowym [13]. Klasyfikuje się je jako asymptomatyczne (bezobjawowe) lub apatogenne (niechorobotwórcze) szczepy o powinowactwie do układu pokarmowego (enterotropowe), a szczepy Ulster 2C, VG/GA i PHY.LMV.42 to najczęściej dostępne na rynku komercyjne szczepy szczepionkowe. Mają one bardzo niski indeks zjadliwości domózgowej – ICPI (ang. Intracerebral Pathogenicity Index) (Tabela 1), przez co nie powoduje odczynów poszczepiennych [15]. Z uwagi właśnie na bezpieczeństwo można je również stosować u jednodniowych piskląt w wylęgarniach.
Istnieją jednak pewne niedogodności związane ze stosowaniem tych szczepionek. Mianowicie są one mniej immunogenne niż szczepionki oparte na szczepach lentogenicznych oraz dodatkowo dochodzi do częściowej interferencji z przeciwciałami matczynymi obecnymi u piskląt. Z tego względu przy stosowaniu szczepionek opartych na tych szczepach wynika konieczność wykonywania częstych szczepień przypominających na fermach, gdzie ryzyko zakażenia chorobą Newcastle jest bardzo wysokie. Działanie takie wymaga regularności i generuje koszty, przez co w praktyce szczepionki te wykorzystuje się raczej w terenach słabo narażonych na wystąpienie endemii Choroby Newcastle.
Szczepionki inaktywowane
W szczepionkach inaktywowanych wykorzystano zarówno szczepy zjadliwe mezogeniczne jak i lentogeniczne, ale z punktu widzenia bezpieczeństwa stosowanie tych ostatnich wydaje się właściwsze, ponieważ po pierwsze pojawia się aspekt manipulacji dużymi ilościami zjadliwych wirusów, a po drugie powstaje zagrożenie wynikające z nieodpowiedniej inaktywacji i możliwości następczego zakażenia podczas szczepienia. Ponieważ nadrzędnym celem jest pobudzenie układu odpornościowego do produkcji swoistych przeciwciał, więc podczas produkcji szczepionki inaktywowanej ważne jest uzyskanie i zastosowanie w dawce dużych ilości antygenów wirusa, ponieważ nie dochodzi do jego namnażania w organizmie. Wyjątkowo wysokie miana można uzyskać przy stosowaniu szczepionek opartych na szczepie VH, jednak niektóre komercyjne szczepionki inaktywowane są wytwarzane na bazie takich szczepów macierzystych jak Hitchner B1, LaSota lub inne [14].
Stosowanie tych szczepionek polega na podaniu ich w formie indywidualnych iniekcji, dzięki czemu każdy ptak z osobna otrzymuje standardową dawkę.
Tabela 1. Szczepy wirusa najczęściej wykorzystywane w produkcji szczepionek przeciwko ND [19]
| Szczep | ICPI | Klasyfikacja |
| PHY-LM V4 | 0,14 | Apatogenny enterotropowy |
| Ulster 2C | 0,14-0,23 | Apatogenny enterotropowy |
| VG-GA | 0,03 | Apatogenny enterotropowy |
| VH | 0,15 | Lentogeniczny klonowany |
| Hitchner B1 | 0,2 | Lentogeniczny |
| Clone 30 | 0,35 | Lentogeniczny klonowany |
| LaSota | 0,4 | Lentogeniczny |
| Muktesvar | 1,4 | Mezogeniczny |
| Komarov | 1,41 | Mezogeniczny |
| Roakin | 1,45 | Mezogeniczny |
Szczepionki wektorowe
Szczepionki wektorowe można pokrótce zdefiniować jako produkt końcowy procesu genetycznej manipulacji na mikroorganizmach, polegającego na izolacji pewnych genów dawcy i wstawieniu ich do materiału genetycznego innego mikroorganizmu będącego wektorem. W ten sposób inicjuje się odpowiedź immunologiczną skierowaną przeciwko obu patogenom: dawcy i wektorowi.
Obecnie na rynku dostępne są dwa rodzaje szczepionek wektorowych przeciwko chorobie Newcastle, które są stosowane w produkcji drobiarskiej. W pierwszym z nich jako wektor wykorzystuje się wirus ospy ptaków (ang. FP, fowl pox), a w drugim nośnikiem jest herpeswirus indyków (ang. HVT, turkey herspevirus). Są one bezpieczne, ponieważ nie narażają ptaków na kontakt z pełnym, zjadliwym wirusem choroby Newcastle, a ponadto nie wchodzą w interakcje z innymi żywymi szczepionkami przeciwko chorobom układu oddechowego, takimi jak zakaźne zapalenie oskrzeli (IB) czy metapneumowirus (APV).
Szczepionki wektorowe zapewniają dość dobrą ochronę przed chorobą Newcastle i ograniczają siewstwo wirusa, jednak i ich stosowaniem wiążą się pewne niedogodności. Mianowicie szczepionka oparta na wektorze ospy (FP) powoduje dość szybkie uzyskanie odporności, bo w ciągu około 2 tygodni, ale trwa ona krótko – nie dłużej niż 8 tygodni. Dodatkowo istnieje spore ryzyko interferencji z przeciwciałami matczynymi, więc rzadko kiedy zalecane są one do stosowania w wylęgarni.
Szczepionki na bazie HVT działają odwrotnie – odporność pojawia się dość późno – po około 4-5 tygodniach, ale utrzymuje się znacznie dłużej, według niektórych producentów szczepionek nawet kilkadziesiąt tygodni [17,19].
Ponadto po zastosowaniu szczepionek wektorowych nie mamy zjawiska pasażowania wirusa szczepionkowego i możliwości „doszczepienia” się ptaków nie zaszczepionych, dlatego ptaki pominięte podczas szczepienia pozostaną wrażliwe na zakażenie wirusem ND do końca życia.
W związku z powyższymi faktami stosowanie szczepionek wektorowych w wylęgarni w obu programach immunizacja wymaga również podania jednodniowym kurczętom szczepionek żywych, opartych na atenuowanym wirusie Choroby Newcastle.
Niemniej jednak szczepionki wektorowe HVT pozwalają na przezwyciężenie problemu interferencji z przeciwciałami matczynymi (ang. MDA, maternally derived antibodies), dość podobnie do żywych i inaktywowanych szczepionek przeciwko chorobie Newcastle stosowanych łącznie w wylęgarniach.
Odczyny poszczepiennie przy żywych szczepionkach
Żywe szczepionkowe wirusy ND o powinowactwie pneumotropowym zapewniają dobrą ochronę, ale niekiedy mogą powodować nawet poważne reakcje poszczepienne ze strony układu oddechowego, szczególnie gdy są stosowane u jednodniowych ptaków. Najczęściej powodem wystąpienia takich reakcji jest niewłaściwa aplikacja szczepionki poprzez podanie spray’u o zbyt małej kropli. Wtedy cząsteczki szczepionki wnikają zbyt głęboko do układu oddechowego i działając drażniąco wywołują reakcję poszczepienną. Efekt ten może być nasilany przez wtórne zakażenia takimi patogenami jak E. coli, Mycoplasma sp. czy Ornithobacterium rhinotracheale, co z kolei może świadczyć o słabej jakości piskląt czy niewłaściwym programie szczepień w stadzie rodzicielskim. Ważną rolę odgrywają też warunki higieniczne w wylęgarni i sama technika lęgu.
W efekcie może to doprowadzić do wzrostu zachorowalności i śmiertelności po szczepieniu, a ostatecznie może niekorzystnie wpływać na parametry produkcyjne stada.
Przy stosowaniu szczepionek żywych, atenuowanych, pneumotropowych, należy wspomnieć o możliwości wystąpienia zjawiska znanego jako „rolling effect”, które to spowodowane jest niewłaściwą techniką masowej aplikacji szczepionki. Polega ono na tym, że jeśli osoba szczepiąca poda szczepionkę nie całemu stadu, a jedynie pewnej jego części, to ptaki zaszczepione będą pasażowały szczep szczepionkowy zakażając nim ptaki uprzednio nie zaszczepione. W rezultacie w stadzie obserwujemy trwający nawet kilkanaście dni efekt poszczepienny w postaci lekkich (zwykle) objawów ze strony układu oddechowego. Zatem o ile nie dojdzie do wtórnych powikłań bakteryjnych, to dodatkowe upadki raczej się nie pojawiają, ale objawowe ptaki wykazują zmniejszenie poboru paszy i zahamowanie wzrostu, co przekłada się na końcowy efekt ekonomiczny stada.
Żywe szczepy enterotropowe namnażają się głównie w jelitach i powodować lokalne uszkodzenia, które mogą zakłócać trawienie i wchłanianie składników odżywczych. Taka reakcja jest często niewidoczna i nawet zaburzenia ze strony układu pokarmowego po szczepieniu nie są postrzegane jako odczyny poszczepienne. Niemniej szczepienie takie może mieć negatywny wpływ na końcowy efekt produkcyjny stada brojlerów.
Chcąc uniknąć odczynów poszczepiennych ze strony układu oddechowego po zaszczepieniu szczepieniu żywym, pneumotropowym wirusem ND, można rozważyć inne podejście do szczepień.
Pierwsza opcja polega na zamianie oddechowych szczepów wirusa ND na szczepy jelitowe. Odczyny poszczepienne w układzie oddechowym wówczas nie wystąpią, ponieważ takie szczepy namnażają się głównie w przewodzie pokarmowy i to tam powstają ewentualne miejscowe odczyny, zwykle nie zauważalne klinicznie w stadzie. Wadą tutaj jest natomiast słaba miejscowa ochrona dróg oddechowych, o tyle ważna, że stanowi pierwszą linię obrony przed zakażeniem NDV.
Drugą opcją jest podejście „oddechowe”. Stosowanie łagodniejszych szczepionek przeciwko ND opartych na szczepach oddechowych (np. Hitchner B1), które nadal zapewniają dobrą odporność miejscową, nie wywołując odczynów ze strony układu oddechowego. Ze względu na relatywnie krótki czas utrzymywania się przeciwciał po podaniu żywych szczepionek przeciwko ND, kurczęta zaszczepione w pierwszym dniu życia powinny otrzymać szczepienie przypominające w celu zapewnienia pełnej ochrony przed chorobą. W przypadku szczepienia przypominającego zaleca się zastosowanie bardziej immunogennej szczepionki na przykład wywodzącej się macierzystego szczepu La Sota.
Odpowiedź immunologiczna wzrasta wraz ze zwiększanie się immunogenności żywej szczepionki [19]. Aby zatem uzyskać wymagany poziom ochrony bez poważnych odczynów poszczepiennych, potrzebne są programy szczepień, które obejmują sekwencyjne stosowanie coraz bardziej immunogennych wirusów lub żywych szczepionką, a następnie szczepionek inaktywowanych.
Szczepionki żywe i inaktywowane oraz żywe i wektorowe
W ciągu ostatnich 25 lat przedmiotem szerokich badań było jednoczesne stosowanie żywych i inaktywowanych szczepionek przeciwko ND u jednodniowych piskląt. Wyniki wskazują, że wyższe miana w testach HI, lepszą ochronę przed zakażeniem terenowym i dłużej utrzymującą się odporność można uzyskać przy skojarzonym stosowaniu żywych i inaktywowanych szczepionek w porównaniu do osobno podawanych szczepionek albo żywych, albo wyłącznie inaktywowanych. Korzyści płynące ze skojarzonego podania drogą aerozolową szczepionki żywej i jednocześnie drogą iniekcyjną szczepionki inaktywowanej już w wylęgarni są szczególnie widoczne przy silnej presji wirusa terenowego. Taki system zwiększa i przedłuża ochronę dzięki połączeniu miejscowej odporności (zapewnionej przez żywą szczepionkę) z odpornością humoralną (krążące przeciwciała wytworzone w odpowiedzi na inaktywowaną szczepionkę). Reasumując, szybko, nawet po 7 dniach, uzyska się miejscową odporność, która zostanie przedłużona o odporność humoralną, która pojawi się po 2-3 tygodniach po szczepieniu i będzie utrzymywać się przez kilka następnych tygodni – dlatego takie rozwiązanie zdecydowanie zaleca się na obszarach, gdzie obserwuje się wysoką presję terenowych szczepów NDV.
Podobne efekty możemy uzyskać przy zastosowaniu systemu szczepienia łączonego – szczepionki żywej atenuowanej i szczepionki wektorowej opartej na wektorze HVT. W wielu wypadkach taki program szczepień wydaje się wystarczający by zabezpieczyć kurczęta brojlerowskie do 6-go tygodnia życia, jednak późne powstawanie dobrej odporności może być wskazaniem do wykonania dodatkowego szczepienia szczepionką żywą w wieku około 3-go tygodnia życia. Działania takie sugeruje się w dużych fermach wielowiekowych oraz na obszarach narażonych na wystąpienie ND.
Mimo, iż obie kombinacje wzmacniają ochronę przed ND, należy pamiętać, że interferencja z przeciwciałami matczynymi (MDA) może nieznacznie zmniejszyć jej skuteczność [15].
Praktyczne podejście do szczepień przeciwko ND
Obecnie, dzięki wprowadzeniu i dość powszechnym stosowaniu modnych, zaawansowanych technologicznie szczepionek wektorowych, podawanie drogą iniekcji inaktywowanych, monowalentnych szczepionek przeciwko ND jest nadal dobrym i skutecznym, choć czasem trochę zapomnianym rozwiązaniem. To sprawdzone i stosunkowo tanie rozwiązanie wprowadzone wiele lat temu i nadal jest stosowane w wielu krajach. Metoda ta nie wymaga żadnego wyszukanego sprzętu, innego niż ten obecnie stosowany do szczepień kurcząt w wylęgarniach na całym świecie, czyli półautomatów iniekcyjnych lub zwykłych ręcznych strzykawek typu Socorex.
Niektóre monowalentne szczepionki inaktywowane opracowane w oparciu o lentogeniczne pneumotropowe szczepy wirusa ND (np. szczep VH) na bazie adiuwantu wodno-olejowego mogą być przeznaczone do podawania również pisklętom jednodniowym [20].
Istnieje wiele skutecznych schematów stosowania szczepionek inaktywowanych i/lub żywych, ale ostateczna decyzja co do wyboru programu szczepienia przeciwko ND należy do lekarza weterynarii. Powinna ona być oparta na dogłębnej analizie i wiedzy o takich parametrach jak poziom odporności matczynej, aktualny stan immunologiczny stada i całej fermy oraz aktualny status epidemiologiczny wirusa ND w regionie.
U brojlerów szczepionkę taką można stosować u ptaków w każdym wieku, więc można ją podawać podskórnie nawet jednodniowym pisklętom, również brojlerów, w dawce 0,1-0,2 ml. W tym przypadku odporność humoralna pojawia się pod koniec 2. tygodnia życia, a pełną odporność uzyskuje się w 4. tygodniu życia. Jest to wynik lepszy lub co najmniej porównywalny z efektem uzyskiwanym po zastosowaniu bardziej zaawansowanych i znacznie droższych szczepionek wektorowych. Oczywiście na takie rozwiązania możemy sobie pozwolić przy stosunkowo niskiej prewalencji wirusa ND w środowisku i przy wystarczająco wysokim poziomie odporności matczynej. Jeśli presja wirusów terenowych rośnie lub miana MDA w badaniach laboratoryjnych nie osiągną zadowalającego poziomu (3-7 grupa mian w badaniu HI lub w klasycznym teście ELISA), zaleca się zastosowanie szczepionki inaktywowanej iniekcyjnie jednocześnie z żywą szczepionką, którą podaje się w oprysku pod postacią grubej kropli (kropla roztworu a średnicy 150-250µm). W ten sposób, po podaniu żywej szczepionki, osiągamy pełną odporność przeciwko ND poprzez dwa różne mechanizmy: po zaledwie kilku dniach od szczepienia osiąga się zadowalający poziom odporności miejscowej, która skutecznie chroni przed chorobą Newcastle przez 2-3 tygodnie, a w międzyczasie inaktywowana szczepionka pobudzi układ odpornościowy do wytwarzania swoistych przeciwciał. Wreszcie, w wieku 4 tygodni można uzyskać pełną odporność przeciwko ND. Taki system ochrony kurcząt zapewnia skuteczną ochronę nawet w obliczu znacznego zagrożenia zakażeniem welogenicznymi szczepami wirusa Choroby Newcastle.
Podobny poziom ochrony w stadach brojlerów można uzyskać przy stosowaniu szczepionek wektorowych w następującym schemacie: 1 dzień: szczepionka wektorowa; faza odchowu: podanie szczepionki inaktywowanej w iniekcji poprzedzone 2- lub 3-krotnym opryskiem grubokroplistym z użyciem żywej szczepionki.
Jednak ze względu na swą cenę szczepionki wektorowe istotnie zwiększają koszt całego programu szczepień, dając wyniki absolutnie porównywalne do programów opierających się na stosowaniu tradycyjnych szczepionek żywych naprzemiennie ze szczepionkami inaktywowanymi, lub schematem użycia szczepionki inaktywowanej zamiast szczepionki wektorowej u piskląt jednodniowych.
Co więcej, należy pamiętać o raczej żmudnym transporcie i przechowywaniu szczepionek wektorowych, które muszą przebywać w temperaturze co najmniej -130°C, a w praktyce oznacza to warunki ciekłego azotu.
Jeśli chcielibyśmy wybrać dwa najskuteczniejsze schematy dla ptaków długo żyjących, czyli niosek jaj konsumpcyjnych i kur w stadach rodzicielskich, byłoby one podobne do schematów szczepienia brojlerów:
- czyli pojedynczej iniekcji szczepionki inaktywowanej w pierwszym dniu życia w przypadku dobrego statusu odporności piskląt w stadzie i niskiego ryzyka zakażenia wirusem terenowym;
- lub podanie w iniekcji pełnej dawki szczepionki inaktywowanej wraz ze szczepieniem szczepionką żywą w formie spray’u w grubokroplistego, jeśli istnieje zwiększone ryzyko terenowego zakażenia ND i wybuchu choroby [21].
W obu przypadkach, ze względu na ograniczony cykl życia przeciwciał, zdecydowanie zaleca się ponowne doszczepienie ptaków w okresie odchowu. Najwyższy poziom odporności można uzyskać poprzez 2- lub 3-krotne podanie żywych szczepionek (np. opartych o szczepy VH czy LaSota) w oprysku grubokroplistym, a następnie poprzez podanie podskórne lub domięśniowe jednej pełnej dawki szczepionki inaktywowanej pod koniec okresu odchowu. W tym systemie należy pamiętać o zasadzie, iż szczepionki żywe zabezpieczają przed chorobą na bieżąco w okresie odchowu, jednakże ostatnie podanie powinno być potraktowane jako tzw. primowakcynacja, czyli przygotowanie ptaków pod podanie szczepionki inaktywowanej (tzw. booster). Najlepsze efekty w postaci wyrównanej i długotrwałej odporności można uzyskać gdy primowakcynacja zostanie wykonana 2-4 tygodnie przed iniekcją szczepionki inaktywowanej [22].
Takie działanie ma na celu zarówno ochronę zaszczepionego stada przed wybuchem choroby, a w stadach rodzicielskich w szczególności – osiągnięcie immunologicznej jednorodności stada. Wysokie miano przeciwciał w stadach rodzicielskich brojlerów wpływa na przeniesienie wysokich mian przeciwciał matczynych na potomstwo. Szacuje się, że stopień transmisji mian przeciwciał z kury rodzicielskiej na potomstwo w przypadku Rzekomego Pomoru Drobiu wynosi około 30%. Oznacza to, że jeśli przykładowo w stadzie średnia mian ND w teście ELISA wynosi 15 000, to spodziewamy się, że potomstwo po tym stadzie będzie miało średnie miano na poziomie ok. 5000.
W badaniach terenowych przeprowadzonych przez firmę Phibro w stadach niosek towarowych w Tajlandii i Izraelu po dwóch szczepieniach z użyciem swojej szczepionki (w wieku 8 i 17 tygodni) średnie miano geometryczne miano w teście ELISA wyniosło 8300-8560, co według powszechnie przyjętego schematu było poziomem bardzo dobrze zabezpieczającym przed chorobą i siewstwem wirusa ND.
Podobne badania wykonane w stadach niosek reprodukcyjnych po programach uwzględniających szczepionki żywe i inaktywowane pozwalały osiągnąć miana powyżej 20 000 w klasycznym teście ELISA. Za poziom przeciwciał zabezpieczający przed chorobą i siewstwem wirusa uznaje się wartość, gdy w teście ELISA miana MDA u piskląt jednodniowych wyniosą około 4000-6000 (4-8 grupa mian w teście HI).
Zatem znając założenia pozwalające na transfer poziomu przeciwciał matczynych na potomstwo na poziomie 30%, można to uznać za wynik zdecydowanie zadowalający.
Prawidłowo przeprowadzone szczepienie inaktywowaną szczepionką pod koniec okresu odchowu, poprzedzone co najmniej dwoma szczepieniami żywymi szczepionkami (np. 6-8 i 10-12 tydzień życia) lub po dodatkowym jednorazowym podaniu szczepionki inaktywowanej w iniekcji (5-10 tydzień życia), pozwala na wytworzenie długotrwałej oporności, utrzymującej się przez co najmniej 60 tygodni. W tym przypadku nie ma potrzeby wykonywania szczepienia przypominającego w fazie produkcyjnej, z wyjątkiem przypadków, gdy hodowca przeprowadza przepierzanie ptaków. Wówczas po zakończeniu przepierzania zaleca się zastosowanie pojedynczej iniekcji szczepionki inaktywowanej, najczęściej jest to szczepionka skojarzona z innymi antygenami (np. IB i EDS) w pełnej zalecanej przez producenta dawce.
Szczepionki inaktywowane na bazie adjuwantu wodno-olejowego można również z powodzeniem stosować u indyków, co potwierdzono w wielu badaniach terenowych, popartych powszechnym ich użyciem w zasadzie na całym świecie [14,17,22].
Tabela 2. Krótkie zestawienie najważniejszych właściwości szczepionek przeciwko ND
| Rodzaj szczepionki | Zalety | Wady |
| Szczepionki żywe atenuowane przeciwko ND | niedrogie
aplikacja masowa szybkie powstanie odporności odporność miejscowa i ogólna podanie ptakom w każdym wieku |
krótkotrwała odporność
konieczne szczepienia przypominające (żywą lub inaktywowaną) niekiedy niedostateczny poziom odporności, szczególnie przy welogenicznych szczepach ND możliwe odczyny poszczepienne możliwy jest “rolling effect” przy niewłaściwej aplikacji |
| Szczepionki wektorowe przeciwko ND | dobra odporność
długotrwała odporność (gdy wektorem jest HVT) szybkie pojawienie się odporności (gdy wektorem jest FP) bezpieczne – brak odczynów poszczepiennych Brak możliwości „rolling effect” |
wysoka cena
podanie indywidualne (pracochłonne) skomplikowane przechowywanie (ciekły azot) konieczne szczepienia przypominające (żywą lub inaktywowaną) krótkotrwała odporność (maks. 8 tygodni przy wektorze FP) późne pojawienie się odporności (6 tygodni przy wektorze HVT) niskie miano MDA przekazywane na potomstwo, jeśli nie wykona się szczepienia przypominającego inaktywowaną szczepionką podanie tylko w 1-szym dniu życia gdy wektorem jest HVT Interferencja z MDA gdy wektorem jest FP |
| Szczepionki inaktywowane przeciwko ND
|
stosunkowo niedrogie
dobra odporność elastyczne dawkowanie (0,1-0,5 ml) podanie w każdym wieku długotrwała odporność (60 tygodni) Szybkie pojawienie się odporności (2-4 tygodnie) wysokie miana MDA przekazywane na potomstwo bezpieczne dla kurcząt brak odczynów poszczepiennych brak „rolling effect” łatwe przechowywanie (lodówka lub temperatura pokojowa) |
podanie indywidualne
ryzyko odczynu poszczepiennego przy przypadkowym ukłuciu osoby szczepiącej
|
Wnioski
Od początków przemysłu drobiarskiego zapobieganie chorobom zakaźnym i upadkom ptaków ma kluczowe znaczenie dla producentów. Na obszarach endemicznego występowania choroby Newcastle zapobieganie jej odgrywa decydującą rolę w programach szczepień. Aby sprostać temu wyzwaniu, dostępnych jest kilka różnych rodzajów żywych szczepionek. Ta ewolucja – od szczepów mezogenicznych powodujących silne odczyny po wyjątkowo bezpieczne szczepionki inaktywowane czy wektorowe przeciwko ND – wyraźnie pokazuje, że naukowcy zawsze zwracali uwagę na wymagania producentów drobiu. Niemniej jednak, pomimo dostępności bardzo skutecznych szczepionek, same szczepienia nie są wystarczające do kontrolowania choroby Newcastle. Rygorystyczne zasady bioasekuracji i odpowiednie procedury sanitarne są niezbędne w skutecznym programie zapobiegania tej chorobie. Należy również wspomnieć, że na wyniki szczepień mogą znacząco wpływać inne czynniki, jak mykotoksyny, czynniki środowiskowe czy współistniejące immunosupresyjne zakażenia wirusowe, takie jak choroba Gumboro, choroba Mareka lub wirus anemii zakaźnej kurcząt. Wszystkie te czynniki należy uwzględniać, także po to by uzyskać jak najlepszą ochronę przed chorobą Newcastle.
Programy szczepień przeciwko ND obejmujące stosowanie żywych i inaktywowanych szczepionek zwykle powodują wytworzenie wyższego miana przeciwciał w surowicy, które powinno utrzymywać się przez cały okres życia ptaka. Do zakażenia ptaków będzie wówczas konieczna większa presja wirusa w środowisku albo bardziej zjadliwy wirus terenowy. Dowiedziono, że wykonanie indywidualnie, sumarycznie dwóch lub więcej szczepień szczepionkami żywymi zabezpiecza ptaki przed objawami klinicznymi, jak również, że żywe i inaktywowane szczepionki stosowane łącznie zapewniają doskonałą odporność układową. Dodatkowo, uzyskanie silnej, miejscowej odporności na błonach śluzowych po takim programie szczepień, zwłaszcza w górnych drogach oddechowych, jest na tyle istotne, że śmiało program taki można uznać za optymalny do regularnego stosowania u ptaków długo żyjących [14,21,22].
Literatura.
- [1] Charlton B.R. et all. Avian disease manual 6th edition 2006; pp.55-60
- [2] Saif Y.M. et al. Diseases of Poultry. 11th edition 2003; pp.63-88
- [3] OIE. Newcastle Disease. Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2012. Vol. 1, pp. 555–574
- [4] Aldous E.W. et al. A molecular epidemiological study of avian paramyxovirus type 1 (Newcastle disease virus) isolates by phylogenetic analysis of a partial nucleotide sequence of the fusion protein gene. Avian Pathology 2003. 32 (3)
- [5] Orsi M.A. et al. Newcastle Disease Virus Vaccine Strains: Immunogenicity is not Influenced by ICPI. Brazilian Journal of Poultry Science 2009; vol. 11
- [6] EFSA (European Food Safety Authority). EU thinking on Newcastle vaccination. International Hatchery Practice 2007. Vol 21 (7)
- [7] Barranon F. Newcastle disease control in poultry. International Hatchery Practice 2008; 22 (6)
- [8] Czegledi A. et al. Third genome size category of avian paramyxovirus serotype 1 (Newcastle disease virus) and evolutionary implications. Virus Research 2006 (120)
- [9] Ballagi-Pordany A. et al. Identification and grouping of NDV strains by restriction site analysis of a region from the F gene. Archives of Virology 1996. Vol 141
- [10] Miller P.J. et al. Identification of new sub-genotypes of virulent Newcastle Disease virus with potential panzootic features. Genetics and Evolution 2015 (29)
- [11] Aldous E.W. et al. Detection and differentiation of Newcastle disease virus (avian paramyxovirus type 1). Avian Pathol. 2001; Vol. 30
- [12] Rehmani S.F., et al. Effect of Mukteswar and Komarov strains of ND vaccines on egg production. Pakistan J. Pharm. Sci. 1989; Vol. 2 (1)
- [13]Koopman R. Newcastle disease vaccination of broilers. International Hatchery Practice 2007; Vol. 21 (5)
- [14]Bello M.B. Diagnostic and Vaccination Approaches for Newcastle Disease Virus in Poultry: The Current and Emerging Perspectives. Hindawi BioMed Research International; 2018
- [15]Absalón A.E. et al. Epidemiology, control, and prevention of Newcastle disease in endemic regions: Latin America. Tropical Animal Health and Production 2019.
- [16]Lin. M.Y. et al. Genetic and antigenic analysis of Newcastle disease viruses from recent outbreaks in Taiwan. Avian Pathology 2003; Vol. 32 (4)
- [17] Dimitrov K.M. et al. Newcastle disease vaccines – A solved problem or a continuous challenge? Veterinary Microbiology 2016; Vol. 206
- [18] Shahin R.G. et al. Protective Efficacy of Some Newcastle Disease Virus (NDV) Vaccination Programs Against Velogenic NDV Genotype VII in Broiler Chickens. Journal of Current Veterinary Research 2019; Vol. 1
- [19] Paniago M.T. Prevention of Newcastle disease – past, present and future. International Poultry Production 2006; Vol. 20 (6)
- [20] Abolnik C. Newcastle Disease – a South African perspective. Proceedings of XIX WVPA Congress, Capetown 2015; www.wvpc2015.com
- [21] Alam S. et al. Comparative Efficacy of three Newcastle Disease Vaccine Strain in Layers. Open Access Journal Veterinaria 2016; Vol. 2 (4)
- [22]Dortmans J. C. et al. Newcastle disease virus outbreaks: Vaccine mismatch or inadequate application? Veterinary Microbiology 2012; Vol. 160