Przez ostatnie 50 lat produkcja drobiu rozwija się dynamicznie, napędzana głównie przez rosnące zapotrzebowanie na tanie białko zwierzęce. Wymagania dotyczące jakości i efektywności ekonomicznej produkcji przy jednoczesnym zachowaniu dobrostanu zwierząt i ciągłej presji na zmniejszanie stosowania antybiotyków, zmuszają producentów drobiu do szukania nowych rozwiązań w kontroli chorób oraz uzyskiwania coraz lepszych wyników produkcyjnych.
Ważnym narzędziem wpisującym się w teraźniejsze wymagania stawiane branży drobiarskiej jest szczepienie, czyli zapobieganie chorobom zakaźnym. Nowe rozwiązania w dziedzinie szczepień, dostępność nowych technologicznie szczepionek takich jak kompleksy immunologiczne i szczepionki wektorowe, są odpowiedzią na zmiany w podejściu do kontroli chorób. Obserwujemy też zmiany w zakresie miejsc, w których wykonuje się szczepienia, a mianowicie z ferm przenoszone są do wylęgarni. Szczepienia w wylęgarni są zautomatyzowane, mogą być lepiej kontrolowane, obarczone mniejszym procentem błędów technicznych i są mniej stresogenne dla ptaków. Obecnie popularna na świecie metoda aplikacji szczepionek in-ovo, czyli bezpośrednio do jaja pod koniec okresu inkubacji zwiększyła jeszcze efektywność i skuteczność szczepień. Firma Phibro Animal Health jest zaangażowana w rozwój badań i wsparcie techniczne optymalizujące metody aplikacji szczepionek w wylęgarni. Coraz aktywniej Firma wspiera wylęgarnie poprzez wprowadzanie systemu kontroli jakości szczepień (audyty) oraz pracę nad nowoczesnymi szczepionkami, w tym szczepionkami przeciwko Chorobie Gumboro.
Gdy na przełomie lat 50 i 60 ubiegłego wieku naukowcy Winterfield i Hitchner opisywali nową chorobę i wirusa ją wywołującego, zapewne nie podejrzewali, że stanie się ona stanie się jedną z najpoważniejszych chorób w przemysłowej hodowli drobiu przez następne ponad 50 lat. Choroba ta znana jako zakaźne zapalenie Torby Fabrycjusza nazywana jest też Chorobą Gumboro (od miasta w USA, gdzie pojawiła się po raz pierwszy w roku 1957). W Europie pierwsze przypadki rozpoznano w drugiej połowie lat 60-tych. Od tego czasu choroba Gumboro na całym świecie uznawana jest za jedną z najważniejszych epidemiologicznie i ekonomicznie.
Wirus Choroby Gumboro jest wirusem bardzo opornym na czynniki zewnętrzne, dlatego w wielu przypadkach zasiedla środowisko fermy i naraża nowo wprowadzone ptaki na wczesny kontakt z wirusem.
Jeżeli ptaki nie będą prawidłowo zaszczepione, to w zależności od zjadliwości wirusa choroba będzie miała różny przebieg: od niespecyficznej, aczkolwiek charakterystycznej immunosupresji, do wysokiej śmiertelności i objawów klinicznych.
Przy wyborze szczepionki i czasu szczepienia należy kierować się ciągłością protekcji ptaków przeciwko wirusom terenowym obecnym na fermie, jakością ochrony ptaków przed wystąpieniem objawów klinicznych, ograniczaniem siewstwa i wypieraniem wirusa terenowego ze środowiska fermy, czyli zahamowanie cyklu Choroby Gumboro.
Obecnie na świecie dostępne są różne rodzaje szczepień pozwalających na lepszą lub gorszą kontrolę choroby. W zależności od wyboru systemu walki z wywołującym ją wirusem stosuje się odpowiednie szczepionki, a mianowicie:
- Szczepionki inaktywowane. Zawierają zabity wirus, podawane są metodą iniekcji.
 ZW zabezpieczaniu stad towarowych brojlerów nie są stosowane, natomiast stanowią one uzupełnienie programu szczepień w stadach rodzicielskich, a ich podanie poprzedzone jest podawaniem szczepionek żywych. Zadaniem szczepionki inaktywowanej jest podniesienie poziomu przeciwciał matczynych (MDA) przekazywanych na potomstwo. Przeciwciała te mają za zadanie chronić młode ptaki przed wczesnymi zakażeniami wirusem choroby Gumboro. Przyjmuje się, iż nioska rodzicielska jest w stanie przekazać swoiste MDA w ilości około 30% aktualnego poziomu swoich przeciwciał. Zatem im wyższy poziom przeciwciał matczynych tym dłuższa ochrona potomstwa.
ZW zabezpieczaniu stad towarowych brojlerów nie są stosowane, natomiast stanowią one uzupełnienie programu szczepień w stadach rodzicielskich, a ich podanie poprzedzone jest podawaniem szczepionek żywych. Zadaniem szczepionki inaktywowanej jest podniesienie poziomu przeciwciał matczynych (MDA) przekazywanych na potomstwo. Przeciwciała te mają za zadanie chronić młode ptaki przed wczesnymi zakażeniami wirusem choroby Gumboro. Przyjmuje się, iż nioska rodzicielska jest w stanie przekazać swoiste MDA w ilości około 30% aktualnego poziomu swoich przeciwciał. Zatem im wyższy poziom przeciwciał matczynych tym dłuższa ochrona potomstwa.
- Konwencjonalne żywe szczepionki atenuowane. Jest to najstarsza metoda uodparniania ptaków przeciwko Chorobie Gumboro i wciąż bardzo skuteczna, o ile
 szczepienie zostało wykonane prawidłowo. Szczepionki są podawane przede wszystkim w wodzie do picia, choć niektóre z nich mogą być podawane również w kropli do oka. Do produkcji tych szczepionek używane są szczepy wirusów o różnym poziomie atenuacji. Najbardziej popularne to szczepionki oparte na szczepach: pośrednich (MB, D78, Bur706), pośrednich plus (228E, V877) oraz coraz rzadziej – gorących (Winterfield 2512, Komarov). O wyborze rodzaju szczepionki decyduje sytuacja epizootyczna na fermie i w regionie, zaś o terminie szczepień – obserwacja stada do czasu planowanego szczepienia oraz stosowne obliczenia na podstawie wyjściowego poziomu przeciwciał matczynych określanego serologicznie testem ELISA w pierwszych trzech dniach życia pisklęcia. Jeśli więc termin szczepienia został ustalony prawidłowo, a sama technika i proces szczepienia przebiegły bez zakłóceń, to możemy się spodziewać, że wirus szczepionkowy pokona barierę wciąż obecnych przeciwciał matczynych (MDA) i będzie mógł replikować w Torbie Fabrycjusza, co pobudzi to układ immunologiczny ptaka do produkcji swoistych przeciwciał. Niestety ta metoda uzyskiwania odporności choć w założeniach prosta i bardzo skuteczna, posiada kilka elementów, z których zaniedbanie jednego (np. odpowiednie pobranie prób do badania, badanie serologiczne, status stada przed szczepieniem, technika szczepienia, pobranie szczepionki przez ptaki, współtowarzyszące choroby bądź spadki odporności itp.) może wpływa na skuteczność szczepienia.
szczepienie zostało wykonane prawidłowo. Szczepionki są podawane przede wszystkim w wodzie do picia, choć niektóre z nich mogą być podawane również w kropli do oka. Do produkcji tych szczepionek używane są szczepy wirusów o różnym poziomie atenuacji. Najbardziej popularne to szczepionki oparte na szczepach: pośrednich (MB, D78, Bur706), pośrednich plus (228E, V877) oraz coraz rzadziej – gorących (Winterfield 2512, Komarov). O wyborze rodzaju szczepionki decyduje sytuacja epizootyczna na fermie i w regionie, zaś o terminie szczepień – obserwacja stada do czasu planowanego szczepienia oraz stosowne obliczenia na podstawie wyjściowego poziomu przeciwciał matczynych określanego serologicznie testem ELISA w pierwszych trzech dniach życia pisklęcia. Jeśli więc termin szczepienia został ustalony prawidłowo, a sama technika i proces szczepienia przebiegły bez zakłóceń, to możemy się spodziewać, że wirus szczepionkowy pokona barierę wciąż obecnych przeciwciał matczynych (MDA) i będzie mógł replikować w Torbie Fabrycjusza, co pobudzi to układ immunologiczny ptaka do produkcji swoistych przeciwciał. Niestety ta metoda uzyskiwania odporności choć w założeniach prosta i bardzo skuteczna, posiada kilka elementów, z których zaniedbanie jednego (np. odpowiednie pobranie prób do badania, badanie serologiczne, status stada przed szczepieniem, technika szczepienia, pobranie szczepionki przez ptaki, współtowarzyszące choroby bądź spadki odporności itp.) może wpływa na skuteczność szczepienia. - Szczepionki immunokompleksowe. Szczepionki te są przeznaczone do indywidualnej
 aplikacji w wylęgarni za pomocą iniekcji, co pozwala na skuteczną kontrolę jakości szczepienia. Są one produkowane na bazie żywych, atenuowanych wirulentnych szczepów wirusa IBD, które już na etapie produkcji są opłaszczone wyhodowanymi w laboratorium specyficznymi przeciwciałami. Wirus jest uwalniany z tego kompleksu immunologicznego wraz z postępującym naturalnie spadkiem poziomu przeciwciał matczynych (MDA) u piskląt. Uwolniony z wirus szczepionkowy podobnie do konwencjonalnych atenuowanych replikuje w Torbie Fabrycjusza i sieje się do środowiska kurnika. Jest to istotne, gdyż nawet pominięte przy iniekcji pisklęta mająmożliwość „doszczepienia się” drogą pokarmową od reszty stada i będą w stanie wykształcić odporność.
aplikacji w wylęgarni za pomocą iniekcji, co pozwala na skuteczną kontrolę jakości szczepienia. Są one produkowane na bazie żywych, atenuowanych wirulentnych szczepów wirusa IBD, które już na etapie produkcji są opłaszczone wyhodowanymi w laboratorium specyficznymi przeciwciałami. Wirus jest uwalniany z tego kompleksu immunologicznego wraz z postępującym naturalnie spadkiem poziomu przeciwciał matczynych (MDA) u piskląt. Uwolniony z wirus szczepionkowy podobnie do konwencjonalnych atenuowanych replikuje w Torbie Fabrycjusza i sieje się do środowiska kurnika. Jest to istotne, gdyż nawet pominięte przy iniekcji pisklęta mająmożliwość „doszczepienia się” drogą pokarmową od reszty stada i będą w stanie wykształcić odporność.
- Szczepionki wektorowe.Podobnie jak w przypadku szczepionek immunokompleksowych ich niewątpliwą zaletą jest aplikacja w wylęgarni, a więc skuteczna kontrola jakości
 szczepienia. Złożone są one z wektora – wirusa HVT (serotyp 3 wirusa Choroby Mareka), do którego wbudowany jest ważny dla odpowiedzi immunologicznej gen białka VP2 wirusa choroby Gumboro. Z uwagi na fakt, że szczepionki te nie zawierają pełnego wirusa, nie zachodzi tu proces kolonizacji Torby Fabrycjusza, przez co wirus szczepionkowy nie sieje się do środowiska kurnika i nie pasażuje przez zaszczepione ptaki. Zatem ptaki pominięte przy iniekcji nie mają możliwości „doszczepienia się” drogą pokarmową od reszty stada i pozostają wrażliwe na zakażenie do końca życia. Ponadto w przypadku szczepionek wektorowych opartych na wirusie HVT jako nośniku odpowiedź immunologiczna choć dobra i długotrwała, to pojawia się stosunkowo późno i narasta powoli, co wynika to z samej właściwości wektora. W praktyce więc pełną odporność przeciwko Chorobie Gumboro brojlery uzyskują około 5-6 tygodnia życia, a więc w zasadzie dopiero w wieku ubojowym.
szczepienia. Złożone są one z wektora – wirusa HVT (serotyp 3 wirusa Choroby Mareka), do którego wbudowany jest ważny dla odpowiedzi immunologicznej gen białka VP2 wirusa choroby Gumboro. Z uwagi na fakt, że szczepionki te nie zawierają pełnego wirusa, nie zachodzi tu proces kolonizacji Torby Fabrycjusza, przez co wirus szczepionkowy nie sieje się do środowiska kurnika i nie pasażuje przez zaszczepione ptaki. Zatem ptaki pominięte przy iniekcji nie mają możliwości „doszczepienia się” drogą pokarmową od reszty stada i pozostają wrażliwe na zakażenie do końca życia. Ponadto w przypadku szczepionek wektorowych opartych na wirusie HVT jako nośniku odpowiedź immunologiczna choć dobra i długotrwała, to pojawia się stosunkowo późno i narasta powoli, co wynika to z samej właściwości wektora. W praktyce więc pełną odporność przeciwko Chorobie Gumboro brojlery uzyskują około 5-6 tygodnia życia, a więc w zasadzie dopiero w wieku ubojowym.
- Iniekcyjne żywe szczepionki atenuowane. Jest to innowacyjne rozwiązanie firmy Phibro Animal Health na potrzebę uzyskania jeszcze bardziej skutecznej ochrony przeciwko
 chorobie Gumboro. Nowatorska koncepcja zapobiegania Chorobie Gumboro oparta jest na niekonwencjonalnej, żywej szczepionce atenuowanej MB-1, która jest podawana w wylęgarni metodą iniekcji in ovo w 18 dniu inkubacji lub podskórnie w pierwszym dniu życia. Odpowiednio zmodyfikowany szczep pośredni MB wirusa warunkuje stabilność i bezpieczeństwo szczepionki i podobnie jak konwencjonalne, atenuowane wirusy szczepionkowe replikuje w Torbie Fabrycjusza.Zasiedlenie Torby Fabrycjusza przez wirus szczepionkowy w odpowiednim momencie jest bardzo istotne, gdyż o stanowi skuteczną blokadę przed replikacją wirusów terenowych, w tym szczepów very virulent IBDV.
chorobie Gumboro. Nowatorska koncepcja zapobiegania Chorobie Gumboro oparta jest na niekonwencjonalnej, żywej szczepionce atenuowanej MB-1, która jest podawana w wylęgarni metodą iniekcji in ovo w 18 dniu inkubacji lub podskórnie w pierwszym dniu życia. Odpowiednio zmodyfikowany szczep pośredni MB wirusa warunkuje stabilność i bezpieczeństwo szczepionki i podobnie jak konwencjonalne, atenuowane wirusy szczepionkowe replikuje w Torbie Fabrycjusza.Zasiedlenie Torby Fabrycjusza przez wirus szczepionkowy w odpowiednim momencie jest bardzo istotne, gdyż o stanowi skuteczną blokadę przed replikacją wirusów terenowych, w tym szczepów very virulent IBDV.
Wirus szczepionkowy MB po dostaniu się do organizmu adaptuje się do aktualnego statusu immunologicznego każdego ptaka indywidualnie replikując w optymalnym czasie, skorelowanym z postępującym spadkiem przeciwciał matczynych (MDA). Nie mamy więc w tym przypadku do czynienia z „okienkiem immunologicznym”, gdyż spadkowi poziomu MDA (początkowo wiążących wirusy szczepionkowe) towarzyszy równoległy wzrost poziomu własnych przeciwciał stymulowanych replikacją wirusa szczepionkowego w Torbie Fabrycjusza.Bardziej szczegółowy sposób działania tego specjalnie zmodyfikowanego wirusa szczepionkowego opiera się na sposobie, w jaki wirus dostaje się do organizmu i jest rozpoznawany przez matczyne przeciwciała. Przeciwciała, wbrew wielu opiniom, nie niszczą wirusów, a jedynie je dezaktywują na pewien czas uniemożliwiając ich replikację. To także dzieje się, gdy wirus MB-1 dostanie się do organizmu i napotka matczyne przeciwciała, które rozpoznając określone antygeny na powierzchni wirusów agregują je, tworząc kompleksy antygen-przeciwciało. Przeciwciała matczyne podlegają apoptozie, a ich cykl życiowy matczynych przeciwciał przeciwko IBD wynosi kilka dni (okres półtrwania u brojlerów wynosi 3 dni), a więc jest krótszy niż możliwość przetrwania wirusa związanego w kompleksie wirus-przeciwciało. Dlatego po pewnym czasie, wirus zostanie uwolniony z kompleksu i będzie w stanie stymulować układ odpornościowy kurcząt do produkcji specyficznych przeciwciał IBD.Jak wcześniej wspomniano, wirus szczepionkowy po odpowiednim czasie kolonizuje kaletkę i pobudza układ odpornościowy do wytworzenia odporności, niezależnie od poziomu przeciwciał matczynych (MDA). Przy wysokich poziomach MDA, gdy następuje apoptoza matczynych przeciwciał wiążących wirusa, nieaktywne przeciwciała można częściowo zastąpić nowymi, wciąż krążącymi MDA. Chociaż poziom (ilość) przeciwciał matczynych jest ograniczony, dlatego już nieaktywnych przeciwciał nie można całkowicie zastąpić nowymi (świeżymi). Dodatkowo układ odpornościowy kilkudniowego pisklęcia w 100% opiera się na odporności matki i nie jest jeszcze w stanie wytworzyć własnych swoistych przeciwciał, które mogą hamować aktywność wirusa szczepionkowego.
Jeśli poziom MDA jest bardzo niski (a nawet mamy do czynienia z ptakami SPF) przede wszystkim należy zastanowić się, dlaczego pisklęta mają niski status immunologiczny. Być może powinniśmy pomyśleć o poprawie techniki szczepień lub zmianie programu szczepień stada rodzicielskiego. Po drugie, nawet jeśli matczyne przeciwciała są obecne w niewielkiej ilości, nadal będą tworzyć kompleks immunologiczny razem z wirusami, ale być może te kompleksy rozpadną się wcześniej lub utworzą się w mniejszej ilości. Jednak w odpowiednim momencie nadal będą w stanie kolonizować Bursę i skutecznie stymulować układ odpornościowy do produkcji specyficznych przeciwciał IBD.
Jest to w dużej mierze tajemnicą, dlaczego, jeśli przeciwciała i antygen tworzą kompleks, wirus nie jest natychmiast niszczony przez inne humoralne mechanizmy odpornościowe, takie jak interferony (IFN-γ), fagocyty, białka dopełniacza, komórki NK, interleukiny (IL) i inne. Właściwie wiemy, że taka neutralizacja nie następuje, ponieważ przede wszystkim układ odpornościowy młodego ptaka nie jest jeszcze w pełni rozwinięty i nie wszystkie mechanizmy odpornościowe są w pełni funkcjonalne. Po drugie, taki kompleks jest rozpoznawany przez układ odpornościowy ptaka jako „własny”, ponieważ zawiera własne przeciwciała. W ten sposób może krążyć w ciele pisklęcia, dopóki kompleks przeciwciało-antygen nie uwolni wirusa i nie pobudzi dostatecznie dojrzałego układu odpornościowego do produkcji własnych swoistych przeciwciał. Podobny mechanizm zachodzi również w przypadku gotowych szczepionek immunokompleksowych, w których kompleks wirus + przeciwciało jest sztucznie stworzony w laboratorium. W odróżnieniu od nich, podanie szczepionki MB-1 powoduje, iż każdy pisklak tworzy własny kompleks, oparty na swoich indywidualnych krążących przeciwciałach, a wirusa mogącego stymulować Torbę Fabrycjusza do produkcji swoistych IBD przeciwciał uwalnia w odpowiednim czasie, indywidualnie u każdego pisklęcia, w zależności od jego wyjściowego poziomu przeciwciał matczynych.
Bezpieczeństwo szczepionki MB-1 jest podobne do bezpieczeństwa szczepionek podawanych do wody czy pozostałych szczepionek p/IBD podawanych metodą iniekcji. Rewersja wirusa do formy zjadliwej nie jest możliwa, a dodatkową przewagą jest potwierdzony badaniami terenowymi fakt, że skuteczna odporność przed chorobą pojawia się kilka dni wcześniej w porównaniu do szczepionki immunokompleksowej.
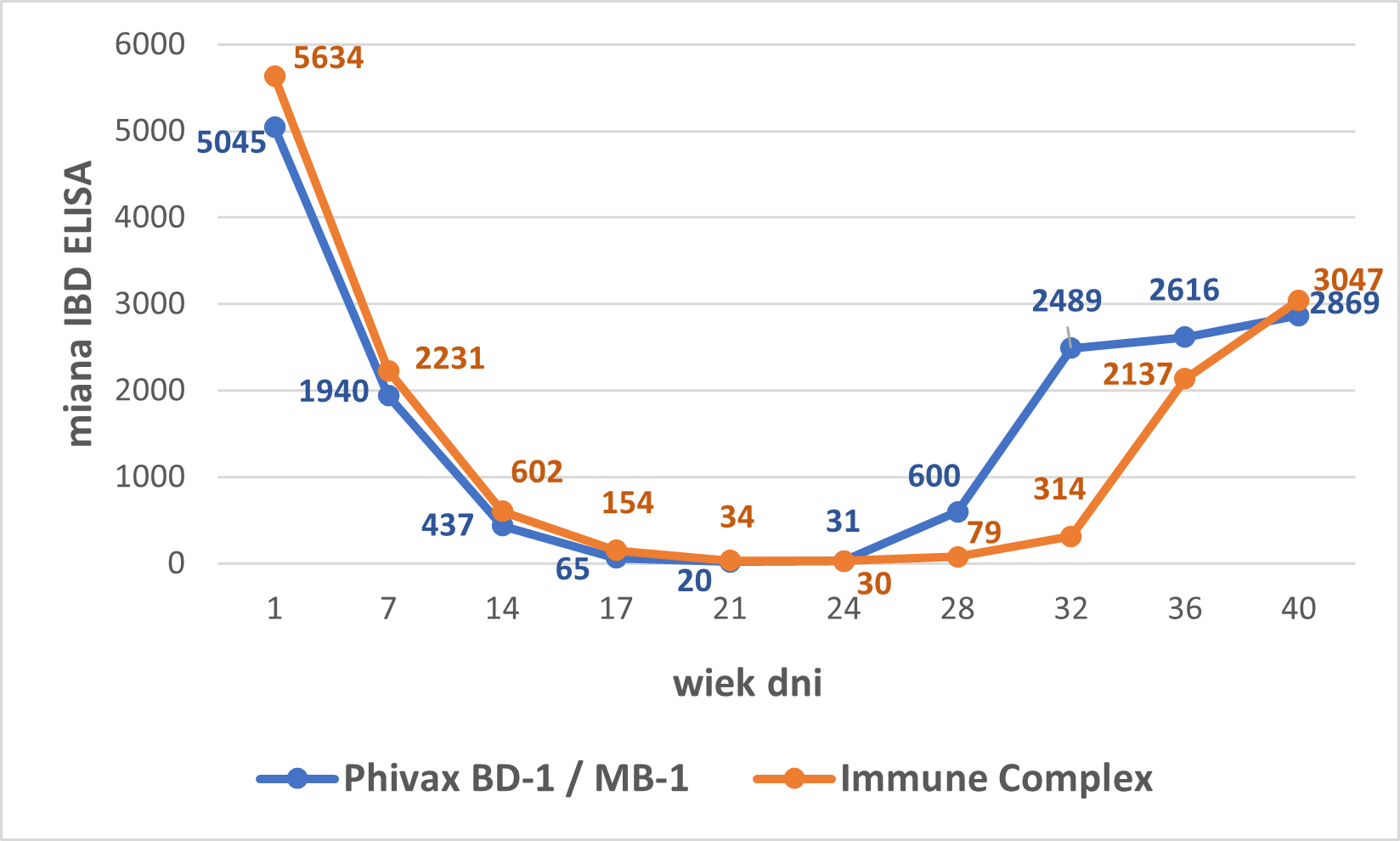
W terenowym teście wykonanym w Brazylii w 2017r ptaki zaszczepione MB-1 osiągały skuteczne poziomy przeciwciał odpornościowych już w 28 dniu życia, podczas gdy przypadku stosowania szczepionek immunokompleksowych takie poziomy ptaki osiągały dopiero w 32 dniu życia. To jednoznacznie pokazuje, że w przypadku MB-1 odporność powstaje o 4 dni szybciej. Dane te pokazują, że replikacja szczepu szczepionki MB-1 w Bursie brojlerów miała miejsce w wieku 16–18 dni (10 dni przed początkiem pojawieniem się mian przeciwciał), podczas gdy wirus szczepionki kompleksowej rozpoczął replikację w 20–22 dniu życia.
Dane z innych badań terenowych przeprowadzonych w Rosji, Indonezji, Argentynie i RPA prowadzą do podobnych wniosków i obserwacji. Bardzo istotnym jest brak jakichkolwiek negatywnych skutków dla wydajności szczepionych ptaków. Przeciwnie, ptaki zaszczepione szczepionką MB-1 w porównaniu do alternatywnych metod szczepienia przeciwko Ch. Gumboro charakteryzowały się niższym parametrami FCR i śmiertelności, lepszą wydajnością mięsa z m2, wyższą masą ubojową i wyższymi przyrostami dziennymi. W grupie tej niższy był także odsetek ptaków z wtórnymi powikłaniami bakteryjnymi (kolibakterioza, zapalenia stawów, zapalenia układu oddechowego).
Zebrane dane wskazują, że szczepienie żywą szczepionką MB-1 zmniejsza narażenie na zakażenie terenowymi szczepami IBD, zapewniając tym samym lepsze wyniki produkcyjne.
Podsumowując zalety nowego rozwiązania w zapobieganiu chorobie Gumboro opartego na zastosowaniu szczepionki MB-1, możemy powiedzieć, że w tym przypadku każdy ptak w stadzie otrzymuje taką sama, kontrolowaną dawkę wirusa, co przy podaniu konwencjonalnych szczepionek do wody nie jest możliwe. Wydajne siewstwo wirusa szczepionkowego do środowiska kurnika pozwala na „doszczepienie się” drogą układu pokarmowego ptaków pominiętych przy szczepieniu (zwykle 0,5 – 3%), co także poprawia wyrównanie immunologiczne stada.
Należy także podkreślić wyjątkowy potencjał szczepionki MB-1, polegający na zdolności przerywania powtarzającego się cyklu choroby Gumboro na fermie. Wirus szczepionkowy kilka dni wcześniej w porównaniu do konkurencyjnych rozwiązań replikuje i zasiedla Torbę Fabrycjusza, przez co osiąga wczesną zdolność wytwarzania pełnej protekcji przed wejściem i replikacją szczepów terenowych, nawet wysoce zjadliwych.
Pomimo iż szczepionka na rynku znajduje się dopiero od kilku lat, to jest już dostępnych wiele naukowych publikacji dotyczących jej kompatybilności i stosowania MB-1 z innymi szczepionkami czy antybiotykami:
- nie ma żadnych przeciwskazań do jednoczesnego podawania szczepionek przeciwko chorobom układu oddechowego drogą aerozolową (przeciwko IB, ND, APV)
- dopuszczalne jest jednoczesne szczepienie drogą iniekcyjną z zastosowaniem szczepionek żywych (np. przeciwko Chorobie Mareka) lub wektorowych (np. przeciwko Ch. Mareka i ILT lub Ch. Mareka i ND). Iniekcja taka może być wykonana in ovo, a w przypadku piskląt jednodniowych na jednostrzykawkowych półautomatach szczepiących przystosowanych do pojedynczej iniekcji. W tym przypadku dwie szczepionki zmieszane są razem i podawane są poprzez jedną strzykawki drogą pojedynczej iniekcji.
- dopuszczalne jest szczepienie z jednoczesnym stosowaniem szczepionek inaktywowanych (Nectiv Forte przeciwko Chorobie Newcastle). Ponieważ szczepionka Nectiv Forte oparta jest na adjuwancie olejowym, to jednoczesną aplikację wraz z MB-1 zaleca się wykonać półautomatem dwustrzykawkowym (przystosowanym do podawania dwóch szczepionek w jednej iniekcji, np. Biojector IV Double). W tym przypadku szczepionki podawane są poprzez dwie niezależne strzykawki, a ich mieszanie się zachodzi dopiero w igle szczepiącej.
- jednocześnie z antybiotykami np. ceftiofur (Excelen, Naxcel) or gentamycin sulphate.
- po zastosowaniu MB-1 nie ma potrzeby powtarzania szczepienia przy użyciu konwencjonalnych szczepionek przeciwko Ch. Gumboro aplikowanych w wodzie do picia. W stadach rodzicielskich brojlerów wskazane jest zastosowanie dodatkowo, szczepionek inaktywowanych iniekcyjnych (np. Quadractin) zgodnie z normalnym programem szczepień, podobnie jak w schematach z użyciem klasycznej, żywej szczepionki atenuowanej, aplikowanej w wodzie do picia.
Reasumując, każdy z opisanych/przedstawionych systemów protekcji posiada swoje wady i zalety, które w skrócie zostały przedstawione w poniższej tabeli:
| Classic live | Immune-complex | Vector | Injected live | |
 |
 |
 |
 |
|
| Main advantage | Early OOI | Hatchery individual application | Hatchery individual application | Hatchery individual application;
Early OOI |
| Main disadvantage | Application | Delayed OOI | Delayed OOI | – |
| Range of use | broilers, layers, breeders | broilers | broilers, layers, breeders | broilers, layers, breeders |
Niewątpliwą zaletą nowego rozwiązania oprócz możliwości bardzo skutecznej aplikacji szczepionki w wylęgarni jest także jest możliwość jej zastosowania u wszyskich typów produkcji, tj. nioski towarowe i nioski reprodukcyjne.
Dzięki bezpiecznej replikacja szczepionkowego szczepu pośredniego także u ptaków długo żyjących uzyskujemy pełną protekcję przeciwko objawom klinicznym choroby. Powszechnym szczepieniem MB-1 jesteśmy w stanie stworzyć barierę ograniczającą siewstwo wirusów terenowych i możliwość zasiedlania ferm przez wirulentne szczepy terenowe, co może przyczyniać się do ogólnej poprawy sytuacji epizootycznej w regionie.