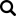Minął rok, odkąd ludzkość poznała nową odmianę koronawirusa, znanego jako SARS CoV-2, a słowa koronawirus czy koronawiroza stały się najczęściej wymienianymi praktycznie we wszystkich językach świata. Do tej pory w ludzkiej populacji, w ciągu ostatnich 20 lat poza trzema przypadkami bardziej znaczących epidemii związanych z koronawirusami (SARS i MERS), które wystąpiły na terenie Azji zakażenia koronawirusowe były odpowiedzialne za sezonowe przeziębienie o lekkim przebiegu [1].
Wielu badaczy zaczęło sugerować odzwierzęce pochodzenie wirusa, wskazując na nietoperze lub łuskowce [2]. Dlatego pojawienie się na przełomie 2019 i 2020 roku odmiany koronawirusa o dużej zaraźliwości, ciężkim przebiegu z relatywnie wysoką śmiertelnością i o globalnym zasięgu wywołało powszechny strach i znaczną dezorganizację życia społecznego. Aktualną pandemię zaczęto nawet porównywać do światowej epidemii grypy tzw. „hiszpanki”, wywołanej przez wysoce zjadliwą odmianę wirusa grypy A H1N1. Epidemia ta w latach 1918-1920 miała prawie światowy zasięg, a według szacunków przyczyniła się do śmierci od 50 do 100 mln ludzi. Patogen, który wywołał tę pandemię według przeprowadzonych badań prawdopodobnie także pochodził od zwierząt, najprawdopodobniej od dzikiego, migrującego ptactwa [3].
Celem tej publikacji jest przekazanie jak najwięcej uporządkowanych informacji dotyczących koronawirusów ptaków hodowlanych i ludzi, samego wirusa SARS CoV-2, jego epidemiologii i ogólne nakreślenie możliwość zwalczenia epidemii poprzez powszechne wprowadzenie nowoczesnych szczepionek. Jest tego sporo, a więc ad rem.
Wirusy
Według wielu naukowych definicji wirusy to nieożywione organizmy, które namnażają się (replikują) wewnątrz żywych komórek. Wirusy nie są zbudowane z pełnych komórek, nie mogą utrzymać się w stabilnym stanie, nie rosną i nie mogą wytwarzać własnej energii. Mimo, że wirusy intensywnie się replikują i adaptują do swojego środowiska, bardziej przypominają androidy niż prawdziwe żywe organizmy. Nieożywionego organizmu nie można zabić, chociaż można powstrzymać jego namnażanie. To część problemu związanego z wirusami i jeden z powodów, dlaczego chorób wirusowych nie można łatwo wyleczyć. Unieszkodliwienie wirusa to zupełnie inny proces niż zabicie komórki bakteryjnej. Bakterie to żywe organizmy, które można dość łatwo zabić np. przy pomocy antybiotyków i tym samym łatwiej przez to ograniczyć ich szerzenie. HIV, Ebola, SARS CoV-2, wścieklizna, grypa to niektóre choroby wywoływane przez wirusy, które są trudne lub niemożliwe do skutecznego wyleczenia. Można im jednak zapobiec dzięki szczepionce. Sam koronawirus jest dość wrażliwy na takie czynniki jak powszechne środki dezynfekujące, detergenty, wysuszanie i wysoką temperaturę oraz działanie promieni słonecznych, które strukturalnie denaturują jego otoczkę białkową lub niszczą jego materiał genetyczny (RNA).
Etiologia koronawiroz
Koronawirusy są silnie zróżnicowaną grupą wirusów z rzędu Nidaviridae, u różnych gatunków zwierząt wywołującą choroby różnych układów: pokarmowego, oddechowego czy nerwowego. Wywołują choroby o znaczeniu ekonomicznym w hodowlach przemysłowych, mogą przenosić się międzygatunkowo, a więc zarażać ssaki; są patogenami odzwierzęcymi i mogą powodować ciężkie choroby głównie układu oddechowego u ludzi [4].
W zależności od struktury genomu w obszarze kodującym enzym replikzę RNA koronawirusy dzielimy na cztery rodzaje: alfa-, beta-, gamma- i deltakoronawirusy. W bardzo ogólnym podziale przyjmuje się, że alfa- i betakoronawirusy występują głównie u różnych gatunków ssaków, zaś gamma- i deltakoronawirusy przede wszystkim u ptaków [1].
Ich budowa niezależnie od przynależności do rodzaju jest praktycznie identyczna. Zewnętrzną część wirionu stanowi sferyczna otoczka, na powierzchni której znajdują się białka otoczki (E) odpowiedzialne m.in. za formowanie wirionów oraz białka błonowe (M) będące głównym białkiem macierzy wirusa. Wewnętrzną część stanowi nukleokapsyd, którego białka (N), pełnią dwie podstawowe funkcje – chronią cząsteczkę RNA i aktywnie uczestniczą w modyfikacji procesów komórkowych i replikacji wirusa. Z kolei wewnątrz kapsydu znajduje się genom zbudowany z jednoniciowego RNA. Charakterystyczny wieniec na powierzchni otoczki przypominający koronę (stąd nazwa koronawirus) tworzą głównie białka szczytowe S odpowiedzialne za interakcję z receptorem na powierzchni komórki oraz w mniejszym stopniu białka dimeru esterazy hemaglutyniny (HE), które poprawiają zdolność wirusa do przenikania przez błony śluzowe [5].
Źródło: ECDC (Źródło: European Centre for Disease Prevention and Control)
Koronawirus ptaków IB-CoV należy do gamma-koronawirusów i wywołuje wysoce zaraźliwą chorobę kur – zakaźne zapalenie oskrzeli (IB). Choroba ta stanowi poważny problem epizootyczny na całym świecie i jest uważana za jeden z najpoważniejszych czynników powodujących wysokie straty w przemyśle drobiarskim. Wirus ten charakteryzuje się bardzo dużą zmiennością, występuje w wielu serotypach i odmianach antygenowych [6]. Następstwem zakażenia są zwykle objawy ze strony układu oddechowego, zaburzenia w rozrodzie i bardzo często zapalenie nerek. W formie przewlekłej choroba może trwać kilka tygodni a śmiertelność wahać się od 3 do 30%. Bazując na zdobytej wiedzy stworzono drzewo filogenetyczne wirusa IB by uprościć zrozumienie różnic i podobieństw pomiędzy poszczególnymi serotypami IBV. Aktualnie znanych jest ponad 1000 różnych jego serotypów i trudno je przedstawić w formie graficznej na jednym wykresie, jednakże te o największym znaczeniu ekonomicznym i epizootycznym zostały zamieszczone poniżej.
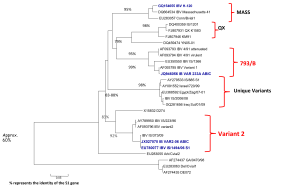
Źródło: Materiały naukowe Phibro Animal Health Corp
Dodatkowo, w związku ze znaczną zmiennością wirusy IB uporządkowano w grupy genetyczne od GI do GVI. Najbardziej znany i rozpowszechniony jest genotyp GI, w obrębie, którego znajdują się te odkryte najwcześniej i występujące na całym świecie szczepy wirusa IB – Massachusetts H120 czy M41. Pewne warianty IB dominowały w niektórych krajach w krótszym czasie. To zjawisko dotyczyło tzw. wariantów holenderskich D1466 i D274 oraz wariantu włoskiego IT-02 w latach 80-tych i 90-tych XX wieku. Jednak do serotypów o największym znaczeniu ekonomicznym zalicza się przede wszystkim formy patogenne, krążące w środowisku przez dłuższy czas. Aktualnie w rejonie Europy powszechne są serotypy grupy 793B, należące do genetycznej grupy GI-13. Od około roku 2003 w Chinach zaobserwowano obecność nowego serotypu, zaklasyfikowanego do grupy GI-19, znanego pod nazwą QX lub D388, który był główną przyczyną patologii układu wydalniczego i rozrodczego, polegającej na trwałym uszkadzaniu jajowodu we wczesnym okresie odchowu (tzw. „fałszywe nioski”). Na początku XXI wieku na terenie Izraela i krajów przyległych ekonomiczne straty zaczął powodować nowy serotyp IBV, należący do genetycznej grupy GI-23 – IS/1494/06, czyli Var2. Bardzo szybko zakażenie rozprzestrzeniło się w rejonie Turcji, następnie Polski, Ukrainy i Krajów Bałtyckich. Aktualnie szacuje się, iż w Polsce nawet 40% wszystkich zakażeń IB spowodowanych jest właśnie tym wariantem wirusa [7].
SARS-CoV-2, który na gospodarza wybrał sobie człowieka należy do rodzaju betakoronawirusów. Do tej samej grupy koronawirusów należą również SARS i MERS. Dotychczas miały miejsce dwie epidemie SARS – pierwsza, dość lokalnie w Azji wschodniej w latach 2002-03 została opanowana w ciągu 8 miesięcy, zaś bieżąca, określana jako SARS-2 wybuchła na terenie Chin, do dziś osiągając zasięg globalny [8]. SARS-CoV-2 ma sporo podobieństwa do innych ludzkich koronawirusów, z których cztery mogą powodować sezonowe przeziębienia: 229E, NL63, OC43 i HKU1 i tylko one wykorzystują ludzi jako głównych gospodarzy. SARS-CoV-2 dzieli około 90% swojego materiału genetycznego z koronawirusami nietoperzy, co dość jednoznacznie sugeruje, że wirus powstał najpierw u tych zwierząt, a później zaadaptował się do infekowania i namnażania u ludzi. Dowody wskazują, że wirus wskutek genetycznych mutacji przeszedł przez nosiciela pośredniego, czyli zwierzę, zanim rozprzestrzenił się wśród ludzi [9].
Patogeneza koronawiroz
Najwięcej doniesień z zakresu patogenezy koronawirusów dotyczy przede wszystkim SARS i MERS u ludzi, zaś w mniejszym stopniu badania dotyczą wirusów zwierzęcych, w tym koronawirusów ptaków. W obu jednak przypadkach szczególną uwagę zwraca się na rodzaj receptorów komórkowych, tropizm do określonych komórek oraz odporność nieswoistą jako pierwszą linię obrony przeciwzakaźnej [10].
Koronawirusy ludzi i ptaków cechuje wspólny tropizm do komórek nabłonka urzęsionego i nabłonka dolnych dróg oddechowych. Jednak te cztery najbardziej znane koronawirusy człowieka odpowiedzialne za sezonowe przeziębienia mogą wywoływać u ludzi także zakażenia układu pokarmowego i nerwowego [11].
Zakażenie zapoczątkowuje interakcja pomiędzy białkiem szczytowym S1 wirusa a receptorem gospodarza. W zależności od gatunku, koronawirusy wykorzystują różne receptory. Ludzkie wirusy SARS i MERS wyszukują jako docelowy i rozpoznają receptor konwertujący angiotensynę ACE2. Następnie wskutek interakcji wirusa z zakażonym organizmem zmienia się status układu immonologicznego: indukowana jest apoptoza zakażonych wirusem komórek (komórek płuc, śledziony, makrofagów, limfocytów T i innych), przez co z jednej strony hamowana jest replikacja wirusa, ale z drugiej strony dochodzi do osłabiania odpowiedzi organizmu na zakażenie. To zjawisko potęgowane jest prawdopodobnie przez wpływ wirusowych białek M, E i N na supresję syntezy interferonu oraz zakłócanie komórkowych szlaków sygnalizacyjnych (NF-KB) [12].
Charakterystyka koronawiroz ludzi i ptaków
Koronawirusy mają bardzo labilną naturę. Ta genetyczna niestabilność spowodowana jest samą biologią wirusa, którego materiał genetyczny stanowi pojedyncza nić RNA, która podczas replikacji nie posiada mechanizmów naprawczych [13]. W przypadku innych wirusów, których genom zbudowany jest z podwójnej nici RNA lub DNA taki mechanizm istnieje. Mianowicie błąd replikacji jednej nici może być skorygowany przez informacje zawarte w drugiej nici. W przypadku koronawirusów tego mechanizmu nie ma, zatem wskutek przekazania błędnej informacji podczas polimeryzacji łańcucha może teoretycznie powstać wiele różnych wariantów genetycznych, z których jedne ulegną szybkiej terminacji, nieliczne stworzą całkiem nowe mutanty, niekoniecznie patogenne, a jedynie pojedyncze z nich stworzą stabilne serotypy o chorobotwórczych właściwościach.
Dodatkowo, na przykładzie całkiem dobrze poznanej biologii koronawirusów ptasich odpowiedzialnych za zakaźne zapalenie oskrzeli (IB) istnieje obawa, że nowo powstałe zjadliwe serotypy mogą krzyżować się między sobą, tworząc z czasem całkiem odmienne genetycznie formy, słabo podatne na dostępne szczepionki. Za przykład niech posłużą krzyżówki Guangdong i Xindadi powstałe z serotypów QX i 793B.
Dlatego, na dziś naukowcy nie wykluczają scenariusza, że choroba COVID-19 będzie nam towarzyszyła przez dziesięciolecia podobnie jak grypa. I podobnie będzie chorobą sezonową wywoływaną przez różne odmiany wirusa, a zatem co jakiś czas w szczepionkach trzeba będzie „aktualizować” serotypy SARS CoV-2.
Przenoszenie. Koronawirusy przenoszą się międzygatunkowo, ale taka transmisja jest złożonym procesem, uwarunkowanym wieloma czynnikami takimi jak wystąpienie odpowiedniego wektora czy pojawienie się zmian adaptacyjnych na poziomie molekularnym i środowiskowym. Wymaga to stworzenia mechanizmów zdolnych do pokonania specyficznych barier w przyłączaniu wirusa do odpowiednich receptorów, adaptacji do nowych warunków środowiskowych czy wytworzenia zdolności pokonania mechanizmów odpornościowych nowego gospodarza. W przypadku niektórych koronawirusów, w tym SARS CoV-2 udało się to dosyć skutecznie. Uważa się, że ludzkie koronawirusy SARS CoV- 1 i 2 oraz MERS pochodzą od nietoperzy, a inne domowe lub dzikie zwierzęta mogą odgrywać rolę pośredniego nosiciela, który skutecznie umożliwia transmisję zarazka pomiędzy jego naturalnym rezerwuarem a docelowo – człowiekiem. W przypadku SARS CoV-1 najbardziej prawdopodobne stało się przeniesienie zarazka z nietoperzy poprzez pośrednictwo łaskunów (cywet); w przypadku MERS za naturalny rezerwuar uznawane są wielbłądy [14] lub nietoperze [15]. W przypadku SARS CoV-2 za wektor przenoszący wirusa od nietoperzy uważa się pangolina (łuskowca) [16].
Uwarunkowana ich biologią genetyczna niestabilność koronawirusów może wpływać na ich właściwości, takie jak zjadliwość, tropizm tkankowy czy komórkowy, adaptacja do nowych gospodarzy czy zdolności transmisji międzygatunkowej. W rezultacie mogą pojawić się nowe choroby o nieznanym dotąd przebiegu i u nieznanych dotąd gatunów docelowych [17].
Pomimo znanego tropizmu do komórek układu oddechowego jak do tej pory nie zanotowano żadnych doniesień na temat transmisji koronawirusów ptasich na człowieka ani ludzkich na ptaki. Być może jest to uwarunkowane wykorzystaniem różnych receptorów docelowych przez beta- i gammakoronawirusy.
Rozprzestrzenianie. Jesteśmy zgodni, że transmisja pozioma w obrębie populacji (z osobnika na osobnika, u kur z ptaka na ptaka w obrębie stada lub fermy) to podstawowy sposób szerzenia się infekcji, zarówno ludzkiej jak i ptasiej formy koronawirusa. Do zakażenia dochodzi drogą kropelkową poprzez inhalację, kontakt bezpośredni z zakażonymi osobnikami, a na fermie także poprzez kontakt ze ściółką czy zanieczyszczonym sprzętem. W przypadku niedostatecznej bioasekuracji również obsługa fermy, a nawet lekarz weterynarii mogą być wektorem przenoszącym wirusa. I u ptaków i u ludzi transmisja pionowa (z rodziców na potomstwo) nie jest potwierdzona. U kur wirus namnaża się w jajowodach niosek i w jądrach kogutów, więc wirus wydalany z układu rozrodczego czy pokarmowego nioski może zanieczyszczać powierzchnię skorupy jaja i przez to może być źródłem zakażenia piskląt [18].
Teoria spiskowa pierwsza. Czyli prawdopodobieństwo, że wirus SARS CoV-2 to artefakt powstały w laboratorium. Faktycznie, wiosną 2020r ukazało się kilka publikacji sugerujących, że wirus SARS CoV-2 jest wytworem ludzkiej manipulacji genetycznej, powstałym wskutek przemieszania materiałów genetycznych rożnych wirusów chorobotwórczych z ludzkim beta-koronawirusem [19]. Jednak te odważne teorie nie oparły się na solidnych filarach naukowych, przez co nie znalazły poparcia medialnego i społecznego. SARS-CoV-2 bardzo przypomina dwa inne koronawirusy, które wywołały epidemie w ostatnich dziesięcioleciach (SARS-CoV i MERS-CoV), a wszystkie trzy wirusy wydają się pochodzić od zwierząt. Krótko mówiąc, praktycznie wszystkie cechy SARS-CoV-2 są zgodne z tym, co wiemy o innych, naturalnie występujących koronawirusach, także tych które przeniosły się ze zwierząt na ludzi.
Badanie metodami modelowania matematycznego i rachunku prawdopodobieństwa wykazało, że kluczowa część SARS-CoV-2, znana jako białko szczytowe S1, z bardzo dużym prawdopodobieństwem pojawiłaby się w sposób naturalny, a nie jako dzieło modyfikacji laboratoryjnej. Co więcej, gdyby naukowcy próbowali wykorzystać modele komputerowe do stworzenia śmiertelnego wirusa opartego na oryginalnym wirusie SARS, prawdopodobnie nie wybraliby modyfikacji, które faktycznie pojawiają się w SARS-CoV-2. Dzieje się tak, ponieważ symulacje komputerowe pokazują, że aktualnie poznane mutacje w SARS-CoV-2 nie wydają się sprzyjać wirusowi w wiązaniu się z ludzkimi komórkami. Okazuje się jednak, że natura jest sprytniejsza od naukowców, a nowy koronawirus znalazł lepszy i całkowicie inny sposób na mutację, od tego co naukowcy mogli przewidzieć lub stworzyć. Wiele innych badań również dostarczyło mocnych dowodów przeciwko idei „inżynierii laboratoryjnej” i nadal brak jest jakichkolwiek dowodów sugerujących, że wirus CoV-2 został stworzony przez człowieka [20].
Szczepienia ludzi. Niedawno się rozpoczęły. W szybkim tempie opracowano dwa rodzaje szczepionek: oparte na mRNA szczepionki genetyczne oraz oparte na wektorach szczepionki wektorowe.
Idea szczepionki opartej na mRNA wywodzi się jeszcze z lat 80-tych XXw, gdy starano się stworzyć szczepionkę (m.in. przeciwko HIV) działającą poprzez absolutnie nowatorski mechanizm. Badano je dość długo, jednak wcześniej udało się stworzyć dość skuteczne i relatywnie tanie leki umożliwiające kontrolę wielu chorób wirusowych. Faktycznie więc do dziś szczepionki oparte na mRNA (Pfizer, CureVac, Moderna) są iście nowatorskim opracowaniem, którego do tej pory jeszcze go powszechnie nie zastosowano. Szczepionki te zawierają tylko informację genetyczną pozwalającą na produkcję w komórce tylko wybranych białek wirusa, które z kolei są bodźcem dla układu immunologicznego do wytworzenia swoistych przeciwciał. mRNA to taka „instrukcja” jak wyprodukować jedynie białko antygenu wirusowego S, a organizm już wytworzy przeciwko niemu swoiste przeciwciała. Pomimo dość krótkiego okresu od stworzenia do zastosowania szczepionki p/Cov-2 mechanizm jej działania jest znany. Już podczas pierwszej epidemii SARS w Azji w latach 2002-03 opracowano podobnej konstrukcji szczepionkę, którą wystarczająco dobrze zbadano, także pod kątem jej bezpieczeństwa. Szczepionka ta jednak nie wyszła poza ostatni etap badań klinicznych i nie została wprowadzona do powszechnego stosowania, z uwagi na fakt, że pierwsza epidemia SARS wygasła, nawet nie przechodząc do stadium endemii [21]. Alternatywne rozwiązanie szczepionkowe jest znane od wielu lat i powszechnie stosowane, a są to szczepionki wektorowe. Konstrukcje producentów Astra Zeneca, Johnson & Johnson, Sputnik V opierają się na tzw. wektorach, czyli odpowiednio zmodyfikowanych i osłabionych adenowirusach, w których DNA został wszczepiony jedynie gen z RNA koronawirusa SARS-CoV-2 odpowiedzialny za wytwarzanie białka szczytowego S1. Sam adenowirus nie może się namnażać i nie powoduje choroby, pełniąc w szczepionce funkcję nośnika (wektora), który tylko dostarcza gen SARS CoV-2 do komórek organizmu gospodarza. Komórki wykorzystają wprowadzony gen do produkcji białka S, a układ odpornościowy osoby zaszczepionej potraktuje białko S jako obcy antygen, wytwarzając naturalne przeciwciała i limfocyty T przeciw białku S koronawirusa [22].
W obu rodzajach szczepionek ich konstrukcje choć diametralnie różne, minimalizują ryzyko wystąpienia reakcji poszczepiennych i całkowicie eliminują możliwość rewersji CoV-2 do formy chorobotwórczej (zjadliwej).
Pomimo szybkiego tempa ostatecznych badań i wprowadzenia nowatorskich szczepionek, nie należy się obawiać ich niskiej skuteczności. Należy pamiętać, że każdy preparat medyczny przed wprowadzeniem do obiegu musi przejść szczegółowe procedury bezpieczeństwa dla ludzi, zarówno pod kątem skuteczności jak i możliwości wystąpienia działań niepożądanych. Dziś świat jest już inny niż nawet kilkanaście lat temu, a każda z firm farmaceutycznych by uniknąć ewentualnych roszczeń odszkodowawczych najpierw porządnie zbada preparat i jeszcze kilka razy się zastanowi, zanim dopuści go do powszechnego stosowania. Z uwagi choćby na siłę światowych mediów w wypadku porażki taka firma mogłaby stracić reputację, pieniądze, a nawet zakończyć upadłością.
Należy też pamiętać, że dzięki upowszechnieniu szczepień w znacznym stopniu udało się opanować epidemie wielu śmiertelnych chorób. Niektóre z nich jak polio (Heine-Medina), ospa, odra, świnka, różyczka czy błonica w zasadzie odeszły w zapomnienie, a niektóre jak gruźlica, tężec, pneumokoki, żółta febra czy zapalenia wątroby A i B są skutecznie kontrolowane i dziś w zasadzie stanowią problem marginalny.
Szczepienia ptaków. Tu do dyspozycji od wielu lat mamy całą gamę szczepionek. Najszerzej stosowane w produkcji drobiarskiej są szczepionki oparte na żywym, atenuowanym szczepie wirusa. Jest wielu producentów, których szczepionki zawierają różne serotypy ptasiego koronawirusa, homologiczne do najbardziej powszechnych zakażeń. Są to szczepionki oparte na najstarszych szczepach Massachusetts H120, przez najbardziej rozpowszechnione warianty nefropatogenne oparte na szczepach 793B, izraelskich izolatach Var2 (IS1494/06) czy chińskich z grupy QX. Szczepionki te podawane są najczęściej drogą aerozolową i służą do zabezpieczania ptaków wszystkich typów produkcji. Drugą powszechnie stosowaną grupą szczepionek są szczepionki inaktywowane. Są one zwykle oparte na nieaktywnych szczepach wirusa M41 z grupy Massachusetts i są stosowane w zabezpieczaniu stad ptaków długo żyjących tj. niosek towarowych i reprodukcyjnych. Stosowanie żywych, osłabionych wirusów w szczepionkach budzi jednak pewne obawy, a mianowicie teoretycznie istnieje możliwość mutacji i rewersji do formy zakaźnej, choć jak na razie brak jest potwierdzeń, by taki proces mógł mieć miejsce. Ponadto czas trwania odporności po takim szczepieniu jestrelatywnie krótki.
Szalona hipoteza. Powstała na początku epidemii SARS CoV-2 i głosiła, że skoro i u człowieka, i u zwierząt czynnikiem jest koronawirus, to być może szczepionki dla zwierząt w jakimś stopniu zabezpieczają także ludzi. Czy zatem nie można by, przynajmniej niektórych u ludzi zastosować, choćby jako rozwiązanie tymczasowe? Z racji powszechności i bezpieczeństwa stosowania skojarzenie takie padło zwłaszcza w odniesieniu do szczepionek dla ptaków.
Dla przypomnienia: choroba COVID-19 wywoływana jest przez beta-koronawirusa SARS CoV-2, zaś dla drobiu dostępne są szczepionki przeciwko gamma-CoV, który wywołuje zakaźne zapalenie oskrzeli Kur (IB). O ile ze względu na wyjątkowo bolesną iniekcję i silny odczyn poszczepienny trudno jest sobie wyobrazić, by ktoś próbował wstrzykiwać szczepionkę inaktywowaną opartą na adjuwancie-wodno olejowym, o tyle podanie drogą aerozolową szczepionki atenuowanej nie budzi ani tak kontrowersyjnych emocji etycznych, ani silnych efektów ubocznych nie powinniśmy się spodziewać. Jedynie czego można by się obawiać, to najwyżej reakcja alergiczna na obcy antygen szczepionkowy. Jednak w tym przypadku nie należy się oczekiwać odporności krzyżowej pomiędzy ludzkim beta- a ptasim gammakoronawirusem. W pełnej analizie sekwencji aminokwasów w obrębie białka S te dwa rodzaje koronawirusów wykazują jedynie około 60% homologii, co stawia je na prawie skrajnych pozycjach drzewa filogenetycznego [23]. Dla uściślenia – w grupie koronawirusów odpowiedzialnych za IB u ptaków homologia mniejsza niż 99% czyni różnicę pomiędzy wirusem szczepionkowym, a terenowym wirusem zjadliwym.
Dodatkowo należy pamiętać, że generalnie u ludzi i ptaków szczepionki nie chronią przed zakażeniem! Według definicji zakażenie to wniknięcie zarazka do organizmu, a przed tym barierę mogą stanowić jedynie zabezpieczenia fizyczne, izolacja lub zniszczenie wirusa. Krótko ujmując – żadna szczepionka nie chroni przed zakażeniem, ale co najważniejsze, szczepionki chronią przed chorobą i siewstwem wirusa, gdyż uniemożliwiają jego replikację i niszczenie komórek gospodarza. Powstałe po szczepieniu lub przechorowaniu swoiste przeciwciała same także nie niszczą wirusa, a jedynie wiążąc go prezentują (niejako przygotowują i podstawiają) innym mechanizmom odpornościowym (TNF, interleukiny, interferon, białka ostrej fazy itp.) celem inaktywacji i zniszczenia.
Dlatego też prawdopodobne jest, by po szczepieniu zarówno ptaka jak i człowieka aktualnie stosowanymi metodami diagnostycznymi, głównie łańcuchowej reakcji polimerazy (PCR) znaleźć materiał genetyczny koronawirusa. Jeśli wirus znajdzie się w uodpornionym organizmie, krążące przeciwciała pamięci natychmiast uruchomiają pozostałe mechanizmy odpowiedzi immunologicznej. Wirus jest wiązany przez przeciwciała w formy nieaktywnych kompleksów i albo wydalany z organizmu w takiej nieaktywnej formie (zatem nie ma siewstwa zjadliwego wirusa) albo kompleks ten jest niszczony przez inne mechanizmy obronne. Obserwacje poczynione w stadach ptaków szczepionych pozwalają na sugestię, że znalezienie samego RNA wirusa u osobników szczepionych nie świadczy o tym, że są one siewcami i że szczepionki są nieskuteczne [7]. Wydaje się to mieć zastosowanie również u ludzi, choć na obecnym etapie wczesnych szczepień trudno tę hipotezę jednoznacznie potwierdzić [24].
Czas trwania odporności. Jeśli chodzi o odporność po szczepieniu, to u ptaków temat ten jest dość dobrze poznany. Przyjmuje się, że jednokrotne szczepienie szczepionką żywą atenuowaną daje odporność trwającą 4-8 tygodni. Podanie szczepionki inaktywowanej (tzw. booster) po uprzednim przygotowaniu przez szczepienie szczepionką żywą (primowakcynacja) trwa nie krócej niż 20 tygodni, a przeciwciała utrzymują się na wysokim poziomie nawet do wieku około 80 tygodni. Jeśli sprawa dotyczy odporności po przechorowaniu, to ozdrowieńcy ze stad długo żyjących wykazują odporność trwającą od 3 do 6 miesięcy, a w wypadku wysokiej presji wirusa choroba IB ma charakter nawrotowy [7, 18].
Jeśli chodzi o odporność u ludzi – na dziś trudno jednoznacznie określić czas trwania odporności poszczepiennej. Wiadomo, że przeciwciała powstałe po przechorowaniu nie różnią się od przeciwciał wytworzonych po podaniu szczepionki, zatem zarówno ozdrowieńcy jak i pacjenci zaszczepieni będą przez pewien czas posiadali odporność na zachorowanie. Jednak przeciwciała mają to do siebie, że mają określoną żywotność, nawet te zwane przeciwciałami pamięci (IgG), a zależy to w głównej mierze od cech samego wirusa. Dodatkowo mechanizmy odporności u ludzi są nieco inne niż u ptaków, dlatego w ludzkiej populacji przechorowanie niektórych chorób często daje odporność do końca życia (świnka, odra, różyczka) podczas gdy skuteczne uodpornienie wymaga podania dwóch lub więcej dawek szczepionki.
Wirusa SARS CoV-2 wciąż poznajemy, dlatego jak długo utrzymują się przeciwciała po kontakcie – na dziś jest to na etapie teoretycznych rozważań popartych jedynie modelowaniem matematycznym. W praktyce czas trwania odporności będzie zależny od cech osobniczych pacjenta oraz samej biologii wirusa, której wciąż się uczymy. Niemniej uważa się, że nawet ozdrowieńcy po pewnym czasie powinni się zaszczepić, aby przeciwciała przeciwko SARS CoV-2 utrzymywały się na odpowiednim poziomie, który zabezpieczy przed chorobą.
Teoria spiskowa druga, czyli nieznane budzi strach. Nowatorska koncepcja szczepionek genetycznych doprowadziła do powstania skrajnej teorii, że mRNA wirusa szczepionki może wchodzić w interakcję w DNA i tym samym zmieniać ludzki genom. Czym więc różni się RNA od DNA, skoro oba są nośnikami informacji genetycznej?
Kwasy nukleinowe DNA i RNA są polimerami zbudowanymi z monomerów znanych jako nukleotydy. Każdy nukleotyd w DNA zawiera jedną z czterech możliwych zasad azotowych purynowych – adeninę (A), guaninę (G) lub pirymidynowych – cytozynę (C) i tyminę (T). Nukleotydy w RNA mogą także zawierać A, G, C, ale tu tymina jest zastępowana przez uracyl (U). Na przykład, jeśli DNA kodujące nić ma sekwencję 5’-ATGC-3’, to sekwencja odpowiadającego mu RNA to będzie 5’-AUGC-3’.
Kwas deoksyrybonukleinowy DNA, ma postać podwójnej helissy, struktury z dwoma pasującymi do siebie (komplementarnymi) łańcuchami sklejonymi ze sobą. Dwie nici helissy sparowane są w przeciwległych kierunkach, co określa się jako antyrównoległość i jest ważne w procesie powielania DNA. Dwie pojedyncze nici nie mogą dowolnie połączyć się ze sobą i stworzyć podwójną helissę, bo z powodu rozmiaru i grup funkcyjnych zasad azotowych ich parowanie jest wysoce specyficzne: A może parować się tylko z T, a G może parować się tylko z C. To znaczy, że dwie nici DNA podwójnej helissy mają bardzo przewidywalne połączenia między sobą. Na przykład, jeśli sekwencją jednej nici jest 5’- TTAACCGG -3’, to komplementarna nić musi mieć sekwencję 3’- AATTGGCC -5’.
RNA jest zwykle jednoniciowy i znamy kilka typów RNA, z tego cztery główne rodzaje to: informacyjny mRNA, rybosomalny rRNA, transportujący tRNA i RNA regulacyjne. mRNA spełnia funkcję pośrednika między genem kodującym białko i jego produktem białkowym. Czyli jeśli komórka potrzebuje wytworzyć konkretne białko, to gen kodujący to białko zostanie uaktywniony, co dla polimerazy RNA oznacza, że ma stworzyć kopię RNA (transkrypt).
Reasumując, DNA i RNA to dwa różne kwasy nukleinowe, nie mogą dowolnie wchodzić między sobą w interakcję, nie ma możliwości by mRNA ingerował w DNA naszych komórek, nie ma możliwości by pomiędzy tymi kwasami zachodziła swobodna wymiana informacji genowej. Zupełnie inne są dla tych kwasów enzymy polimerazy (replikazy) czy nuleazy, a dodatkowo z grubsza ujmując u człowieka i ptaków RNA jest umiejscowiony w cytoplazmie, zaś DNA w jądrze komórkowym.
Koronawirusy a grypa. Matematyczny model rozprzestrzeniania się IB w stadzie ptaków jest dość zbliżony do grypy, jednak obie choroby charakteryzują się różną dynamiką i przebiegiem. Grypa ptaków stanowi dziś większe wyzwanie, gdyż jej negatywne skutki ekonomiczne wynikające z wystąpienia grypy w populacji drobiu związane są z kosztami zwalczania choroby ponoszonymi przez budżet państwa oraz na terenie UE czasowym zakazem eksportu drobiu. Zwalczanie choroby znacznie utrudnia fakt, że za rozprzestrzenianie wirusa HPAI w dużym stopniu odpowiedzialne jest dzikie ptactwo. Najgroźniejsze dla drobiu są wirusy należące do podtypów H5 i H7, gdyż występują w formie wysoce zjadliwej (HPAI) i powodują bardzo wysoką śmiertelność rzędu 60-80%. Zdecydowana większość wirusów grypy ptasiej jest względnie łagodna i powoduje nisko patogenną formę choroby określaną jako LPAI. Koronawirus ptaków wywołujący IB choć także powoduje dotkliwe straty ekonomiczne, to charakteryzuje się jednak znacznie niższą niż HPAI śmiertelnością, maksymalnie osiągając 30%. Ponadto wirusy HPAI mogą przenosić się międzygatunkowo z ptaków na ludzi i odwrotnie, czego nie można powiedzieć o koronawirusach.
Czy koronawirus SARS CoV-2 jest mniej śmiertelny niż grypa? Chociaż współczynnik umieralności na COVID-19 jest trudny do jednoznacznego wyliczenia, prawie wszystkie wiarygodne badania sugerują, że jest on znacznie wyższy niż w przypadku grypy sezonowej, której śmiertelność np. w USA wynosi około 0,1%, w Polsce ok. 0,2% [25].
Według danych z Johns Hopkins University spośród zgłoszonych przypadków COVID-19 w USA około 3,4% chorych zmarło. Dane Europejskiego Centrum ds. Zapobiegania i Kontroli Chorób (ECDC) mówią o ok. 2,8% śmiertelności wskutek zakażenia SARS-CoV-2 [26].
Jest to tak zwany współczynnik śmiertelności, który określa się dzieląc liczbę zgonów przez całkowitą liczbę potwierdzonych przypadków. Wiele badań szacuje, że około 0,5% do 1% osób zarażonych COVID-19 umrze z powodu tej choroby, ale nawet wtedy śmiertelność około 1% w przypadku COVID-19 jest nadal 5 – 10 razy wyższa niż w przypadku grypy. Ważne jest również, aby pamiętać, że szacunki dotyczące zachorowań na grypę i zgonów z WHO, CDC i ECDC są tylko szacunkami (przyjmują pewne założenia, więc mogą być opatrzone błędami), a nie faktycznymi danymi liczbowymi. ECDC w Europie i CDC w USA nie znają dokładnej liczby osób, które każdego roku chorują na grypę lub umierają z powodu grypy, dlatego liczby te szacuje się raczej na podstawie danych zebranych podczas hospitalizacji z powodu grypy. Ostatnie doniesienia z USA mówią o 20 razy większej ilości zgonów tygodniowo z powodu COVID-19 niż z powodu grypy w najbardziej śmiertelnym tygodniu średniego sezonu epidemicznego grypy [27].
Powtórka z przeszłości?
Światowe epidemie zanim rozlały się po świecie zataczały szerokie koło: od źródła, najczęściej w Azji Środkowej lub Południowej docierały do Europy, a stamtąd w inne zakątki świata. SARS, CoViD-19, nawet słynna „hiszpanka” A-H1N1, która wbrew nazwie wykluła się w północnych Chinach czy „grypa Hong-Kong” A-H3N2 z przełomu lat 60 i 70-tych XX wieku.
Pierwsze ognisko grypy niezwykłej pod względem rozmiarów, gwałtowności i klinicznego przebiegu choroby wybuchło w lipcu 1968 roku właśnie w Hong-Kongu, skąd choroba rozprzestrzeniła się na Wietnam, Singapur, Chiny i Australię. Epidemia szybko ogarnęła największe miasta w USA, a trwając 2 lata zabiła nawet 100 tysięcy osób, czyli dwukrotnie więcej niż zwykła grypa sezonowa. Przez Europę Zachodnią przetoczyły się dwie duże fale, w 1969 i 1971r. W Wielkiej Brytanii i Francji zmarło ponad 30 tysięcy, a w Niemczech – po obu stronach „żelaznej kurtyny” około 50 tysięcy ofiar. W Polsce na przełomie 1971/72 przez półtora miesiąca co tydzień przybywało średnio milion chorych. W czasie tych niespełna dwóch zimowych miesięcy zarejestrowano 5,8 miliona chorych na grypę, której ciężkiemu przebiegowi towarzyszyła wysoka śmiertelność: oficjalnie mówiono o 5 849 zgonów z jej powodu, ale z późniejszych wyliczeń lekarzy wynikało, że łącznie liczba zgonów była ponad pięciokrotnie wyższa.
Tamta epidemia miała sporo cech wspólnych z obecną pandemią SARS CoV-2. Wirus Hong-Kong dotarł na kolejne kontynenty korzystając z rozwoju transportu lotniczego, rozprzestrzenił się gwałtowniej niż zwykła grypa, wywoływał silniejsze objawy i częściej kończył się powikłaniami wielu układów, zwłaszcza oddechowego i nerwowego. W ciągu trzech lat zabił od 1 do 4 milionów ludzi. Zamknięto szkoły, sklepy, fabryki i usługi; w wielu krajach gospodarka została praktycznie sparaliżowana, a z pracą nie nadążały zakłady pogrzebowe. Wirus okazał się odporny na dostępne szczepionki, a prace nad nowymi trwały w zasadzie do samoistnego wygaśnięcia epidemii.
Jest też kilka różnic. W przestrzeni publicznej, w tym na festiwalu Woodstock’69 nikt nie myślał o zachowaniu dystansu, nie noszono maseczek i nie dezynfekowano rąk. Szkoły zamknięto z powodu absencji, a nie profilaktycznie. Zakłady pracy stanęły nie z powodu lock-down’u, tylko przez brak siły roboczej. Ruch lotniczy i turystyka zamarły ze względu na brak klientów i personelu, a nie przez rządowe ograniczenia.
Służby medyczne i świat nauki nie wiedziały jednak, jak groźna jest tamta nowa mutacja wirusa grypy. Jedynie niektóre naukowe czasopisma skrótowo pisały o groźnych następstwach, głównie zapaleniach płuc u osób starszych. O tym, jak ciężkie bywały powikłania i jak wielu osób dotyczyły, dowiedzieć się można było jedynie z oficjalnych raportów publikowanych w statystykach Światowej Organizacji Zdrowia, a dane o śmiertelności zostały przeanalizowane dopiero kilka lat po pandemii.
Podobnie jest dziś: w obliczu dość podobnej pandemii, choć wywołanej innym wirusem, nie sposób jest odpowiedzieć na wszystkie pytania dotyczące koronawirusów. Każdy dzień pandemii przynosi nam nowe dane i rodzi nowe pytania, zarówno wśród naukowców jak i zwykłych obywateli. W gąszczu pytań dotyczących epidemii SARS CoV-2 znajdziemy zarówno te mające choć odrobinę sensu, jak i te kuriozalne, które chyba lepiej przemilczeć.
Nauka poszła bardzo do przodu i wydaje się, że nowoczesne metody diagnostyki oraz postęp w zakresie opracowywania szczepionek zarówno dla zwierząt jak i ludzi zaczynają dawać wrażenie namiastki kontroli nad epidemią SARS CoV-2. Jednak może to okazać się złudne, bo uzyskanie odpowiedzi na kilka, chyba tych bardziej sensownych pytań mogących nam nieco rozjaśnić pojęcie z czym tak naprawdę mamy do czynienia, prowadzi nas ku świadomości jak bardzo nieprzewidywalne są wirusy i jak niewiele wciąż o nich wiemy.
Artykuł ukazał się również w wydaniu III i IV 2021
„ Polskiego Drobiarstwa”
Bibliografia
- [1] Domańska-Blicharz K., et al. Koronawirusy – patogeny ważne z punktu widzenia zdrowia zwierząt i ludzi. Życie Weterynaryjne 2020, 95(6), pp.347-358
- [2] Vijay Krishna , et al. Evolutionary insights into the ecology of coronaviruses. J. Virol. 2007, 81, pp. 4012- 4020
- [3] Al Hajjar S., McIntosh K. 2010 The first Influenza pandemic of 21st century. Ann. Saudi Med. 2010, 30, pp. 1-10
- [4] Huynh , et al. Evidence supporting a zoonotic origin of human coronavirus strain NL63. Virol.2012, 86, pp. 12816- 12825
- [5] Masters S. The molecular biology of Coronaviruses. Adv. Virus Res.2006, 66, pp. 193-292
- [6] Cavanagh D. Coronavirus avian infectious bronchitis virus. Vet. Res. 2007, 38, 281-297
- [7] Hodorowicz W. Infectious Bronchitis – problem wciąż aktualny. Kontrola i skuteczne rozwiązania profilaktyczne, 2021, Życie Weterynaryjne 96(1), pp. 42-50
- [8] https://www.who.int/emergencies/diseases/novel-coronavirus-2019/
- [9] https://search.bvsalud.org/global-literature-on-novel-coronavirus-2019-ncov/
- [10] Gliński Z., Żmuda A. Koronawirusy i koronawirozy człowieka i zwierząt. Życie Weterynaryjne 2020; 95(6), pp. 335-345
- [11] Van der Hoek. Human Coronaviruses. What do they cause? Antivir. Ther. 2007, 12, pp.651-658
- [12] Frieman M, et al. SARS coronavirus and innate immunity. Virus Res. 2008; 133; 101-112
- [13] Forni D., et al. Molecular evolution of human coronavirus genomes. Trend in Microbiology 2017, 25, pp. 35-48
- [14] Alagaili A.N., et al. Middle East Respiratory Syndrome coronavirus infection in dromedary camels in Saudi Arabia. MBio 2014, 5, https://mbio.asm.org/content/5/2/e00884-14
- [15] Li W, et al. Bats are natural reservoirs of SARS-like coronaviruses. Science 2005, 310, pp.676-679
- [16] Zhang T., et al. Pangolin homology associated with 2019-noV. biorxiv 2020. https://www.biorxiv.org/content/10.1101/2020.02.19.950253v1.full
- [17] Cui J., et al. Origin and evolution of pathogenic coronaviruses. Nat. Rev. Microbiology 2019; 17(3), pp:181-192
- [18] Domańska-Blicharz, K. 2018. Zakaźne zapalenie oskrzeli kur – ogólnoświatowy problem w przemyśle drobiarskim. Życie Weterynaryjne 93(6). pp 384-387
- [19] Li-Meng Yan. Unusual features of the SARS-CoV-2 genome suggesting sophisticated laboratory modification rather than natural evolution and delineation of its probable synthetic route. Rule of Law Society & Rule of Law Foundation. NY, USA; team.lmyan@gmail.com
- [20] Bryner J., The coronavirus was not engineered in a lab. Here’s how we know. Live Science, 21.03.2020; https://www.livescience.com/coronavirus-not-human-made-in-lab.html
- [21]PZH, Narodowy Instytut Zdrowia Publicznego, 11.2020. https://szczepienia.pzh.gov.pl/wstepne-wyniki-3-fazy-badan-klinicznych-szczepionek-przeciw-covid-19/
- [22] PZH, Narodowy Instytut Zdrowia Publicznego, 11.2020. https://szczepienia.pzh.gov.pl/wstepne-wyniki-3-fazy-badan-klinicznych-wektorowej-szczepionki-przeciw-covid-19/
- [23] Jackwood M. Avian Coronavirus IBV vs. COVID-19. Similarities and Differences. Phibro Academy 2020; https://academy.pahc.com/catalog/info/id:159
- [24] ECDC News: Facts about COVID-19 vaccines on European Vaccination Information Portal: https://vaccination-info.eu/en/covid-19/covid-19-vaccines
- [25] PZH, Narodowy Instytut Zdrowia Publicznego, 12.2020. http://wwwold.pzh.gov.pl/oldpage/epimeld/grypa/index.htm
- [26] European Centre for Disease Prevention and Control. https://www.ecdc.europa.eu/en/geographical-distribution-2019-ncov-cases
- [27] Asch D.A., et al. Variation in US Hospital Mortality Rates for Patients Admitted With COVID-19 During the First 6 Months of the Pandemic. Journal of American Medical Association. Dec 2020; https://jamanetwork.com/journals/jamainternalmedicine/fullarticle/2774572